28项IND获CDE临床默示许可,首款间充质基质细胞开辟干行业新标准
近日,天士力自主研发的同种异体脂肪间充质基质细胞注射液(NR-20201)获国家药品监督管理局药品审评中心(CDE)批准开展临床,治疗急性缺血性脑卒中。这是CDE批准的国内首款间充质基质细胞药的临床试验申请(IND),也是继2024年10月26日美国FDA批准NR-20201临床试验之后,该疗法再次获得监管机构对其质量标准和机理研究的认可。这标志着我国在间充质基质细胞药物治疗领域迈出重要一步。
间充质基质细胞(Mesenchymal Stromal Cells, MSCs)与间充质干细胞(Mesenchymal Stem Cells,MSCs)虽名称相似,但科学定义与功能机制不同。传统认知中,间充质基质细胞被误认为具有干细胞特性的多能细胞,但其实际作用更偏向于组织修复的“支持者”,而非分化成其他细胞类型的“种子”。
天士力研发团队通过单细胞转录组测序技术和轨迹分析程序,揭示了间充质基质细胞与干细胞的基因表达差异,证明其本质是构成组织间质的基质细胞,主要通过归巢至受损组织并与血管内皮细胞协同作用,激活血管再生与功能修复。此次NR-20201的IND申请打破了长期以来的惯例。不过,国内从业者对于间充质基质细胞与间充质干细胞的身份鉴定问题,依然保持着高度关注。
间充质基质细胞
业界争议焦点透视
今年2月,天士力研究团队发表的一篇题为:Unveiling distinctions between mesenchymal stromal cells and stem cells by single cell transcriptomic analysis的研究论文明确了间充质基质细胞(注:本研究MSCs指间充质基质细胞)不是干细胞,并鉴定出了间充质基质细胞特有的功能性基因谱系。
具体而言,研究人员通过单细胞RNA测序进行比较后发现,间充质基质细胞缺失干性基因,包括SOX2、NANOG、POU5F1、SFRP2、DPPA4、SALL4、ZFP42和MYCN等8个与自我更新和多向分化相关的基因。这些基因在胚胎干细胞(ESCs)、诱导多能干细胞(iPSCs)及成体干细胞(如造血干细胞、神经干细胞)中广泛表达(阳性率>90%),但在所有MSCs中表达率不足0.5%。并且研究人员还鉴定出5个间充质基质细胞独有的功能基因(TMEM119、FBLN5、KCNK2、CLDN11、DKK1),这些基因参与血管重塑、细胞间连接及微环境调控。
此外,拟时间轨迹分析显示,间充质基质细胞位于细胞分化路径的末端,与干细胞的早期发育阶段存在明确的“发育悬崖”(developmental cliff)。这表明MSCs已失去干细胞的自我更新与分化潜能,转而专注于基质功能。
国际细胞与基因治疗协会 (ISCT)给出的推荐定义指出,间充质基质细胞是一类源自间充质的异质性细胞群,存在于身体每个器官中,包含血管周围微环境,包括成纤维细胞、肌成纤维细胞和一小部分干细胞/祖细胞。参考国外回输成纤维细胞的案例,加之干/组细胞成分很少,基本认为间充质基质细胞是不具有靶器官修复替代等干细胞的功能。
此前,被尊称为“MSC 之父”的Arnold Caplan就曾提议,用“药用信号细胞”这一名称来强调MSC的治疗潜力已超越传统干细胞的范畴,同时突出其免疫调节和旁分泌信号传导特性。由此可见,国际上普遍认为间充质基质细胞并不具备干细胞的功能。
实际上,国内业界普遍认为研究和临床使用的间充质干细胞并不具备类似胚胎干细胞和iPSC那样的干性,虽然体外具备三系分化潜能,但是在体内没有看到分化的痕迹,主要通过旁分泌作用起效(也不排除细胞间接触起效)。不过,对于间充质基质细胞与间充质干细胞在更多特性及应用场景下的差异,仍有待进一步深入研究。
国内多款间充质获批临床
谁为间充质基质干细胞
在天士力这款间充质基质细胞取得重要进展的同时,国内间充质干细胞领域也成果频出。今年1月,铂生生物自主研发的艾米迈托赛注射液(人脐带间充质干细胞)在国内获得批准上市,针对激素治疗失败的急性移植物抗宿主病,是国内首款获批上市的间充质干细胞产品,打破了“0”上市产品的状态,这一成果极大地激励了国内相关企业的研发热情。
据不完全统计,2024年至今,国内已有28项关于间充质干细胞的IND申请获批临床,涉及天士力、齐鲁细胞、北科生物、艾尔普再生医学、吉源生物、光谷中源、中盛溯源等23家企业。(如有错漏,欢迎指正)
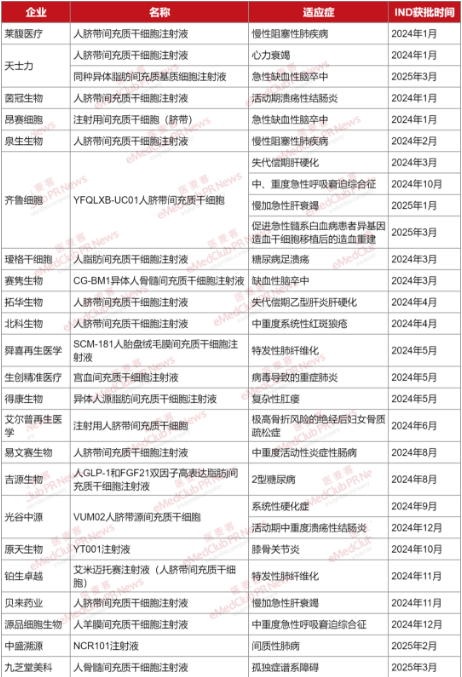
根据统计发现,这些间充质干/基质细胞候选药物的细胞来源主要是以脐带为主的组织。其中,中盛溯源采用iPSC来源的间充质干细胞。
从技术路径来看,组织来源的间充质干细胞获取相对便捷,研究和应用也更为广泛,其安全性和有效性也得到了一定程度的验证,但存在供体差异化和规模化挑战。iPSC来源的间充质干细胞则具有独特的优势,其通过体外重编程获得,理论上可以实现提供无限且均一的间充质干细胞,且可以避免伦理争议。
在间充质干细胞类型上,有2家企业申报的是基因修饰间充质干细胞。吉源生物人GLP-1和FGF21双因子高表达脂肪干细胞注射液是国内首款获批临床治疗2型糖尿病的修饰间充质干细胞,将两个重要代谢调控因子高效表达在脂肪间充质干细胞上,可以实现对糖脂代谢的协同调节。中盛溯源的NCR101是全球首款获批临床的iPSC来源的基因修饰间充质干细胞,也是首款获批临床的治疗间质性肺病的基因修饰间充质干细胞。值得一提的是,NCR101利用iPSC易于基因工程化改造的特性,通过基因修饰技术进一步增强了间充质干细胞疗效,可为间质性肺病治疗提供更多可能性。
在获批适应症上,涵盖呼吸系统疾病、心脑血管疾病、消化系统疾病、代谢及内分泌疾病、自身免疫疾病、神经系统疾病等多种类型,主要通过抗炎修复等发挥作用。以齐鲁细胞人脐带间充质干细胞为例,它可以通过旁分泌机制改变组织微环境,促进肝脏增生及肝脏血管再生,抑制炎症反应,改善肝功能,还可以通过雾化吸入直接作用于肺部,发挥其抗炎、免疫调节、组织修复等功能治疗中、重度急性呼吸窘迫综合征。总体而言,这些作用机制与间充质基质细胞作为组织修复 “支持者” 的角色基本相符,不过仍需进一步深入研究加以确认。
国际尚未有金标准
任重道远
2024年12月,美国FDA正式批准Mesoblast公司的Ryoncil(remestemcel)上市,用于治疗2个月及以上儿科患者的类固醇难治性急性移植物抗宿主病。据该公司新闻稿,Ryoncil是美国首款获批上市的间充质基质细胞,预计将极大地推动学术界和产业界对于间充质基质细胞与间充质干细胞分类的深入认知。
当下,以美国FDA为代表的监管机构,在药品审批等关键环节,会严格依据干细胞发育阶段以及ISCT所制定的鉴定标准,全面评估和监管涉及干细胞与间充质基质细胞的各类产品及疗法,以此确保这些产品和疗法的安全性与有效性。鉴于全球干细胞及相关细胞产品的研发与审批情况极为复杂,尽管 Ryoncil 在美国具有开创性意义,但并不能简单地将其认定为全球首款间充质基质细胞药物。
反观我国,天士力的首款间充质基质细胞刚获批进入临床试验阶段。这一获批时间上的差距以及进展的差异,凸显出我国在间充质基质细胞领域面临着诸多挑战。
技术上,FDA对间充质基质细胞的细胞纯度、活性、旁分泌因子谱等有严格质控要求,而国内尚缺乏统一标准,导致批次间差异大。例如,细胞治疗产品的效力测定方法(如抗炎因子分泌量)尚未形成行业共识。
监管体系上,间充质基质细胞的活体特性要求动态监管(如长期致瘤性监测),国内尚未建立覆盖全生命周期的追溯系统,而FDA通过Sentinel系统实现上市后风险实时监控。
产业链协同与商业化进程也存在瓶颈。规模化制备技术尚不成熟,使得生产成本居高不下。此外,间充质基质细胞类高价值细胞治疗药物很难被纳入医保目录。
近年来,国家对新质生产力的要求日益明确,强调科技创新和高质量发展。随着政策支持的逐步落地、技术水平的不断提升,监管体系也在不断实践中日益健全完善。在此过程中,CDE在审评过程中逐步形成并展现出一套科学化、体系化的审评思路与方法。这一系列积极因素正在推动中国从全球细胞治疗领域的“重要参与者”向更具影响力的“行业引领者”迈进。
参考资料(上下滑动阅览):
1.CDE官网
2.各企业官网
3.Kaijing Y, Fei M, Xiaoxi S, Huizeng W, Pengchong L, Jinlai Z, Xin J, Pengfei H, Xiao Z. Unveiling distinctions between mesenchymal stromal cells and stem cells by single-cell transcriptomic analysis. Heliyon. 2025, 11(4), e42311.
4.https://mp.weixin.qq.com/s/nBIjbDi2MwDbhMJOdQ7Bpg
5.https://mp.weixin.qq.com/s/fkebtzX8iXRL-pA-2UEw0w
6.FDA Accepts Mesoblast’s Biologics License Application (BLA) for Ryoncil® in Children With Steroid-Refractory Acute Graft-Versus-Host Disease (SR-aGVHD). Retrieved July 23, 2024 from https://www.globenewswire.com/news-release/2024/07/23/2917127/0/en/FDA-Accepts-Mesoblast-s-Biologics-License-Application-BLA-for-Ryoncil-in-Children-With-Steroid-Refractory-Acute-Graft-Versus-Host-Disease-SR-aGVHD.html




