自免,通用型细胞疗法的救星?
为了解决CAR-T疗法的高费用,长周期等问题,近年来通用型细胞疗法也逐渐兴起,如通过基因编辑降低GvHD的通用型CAR-T疗法,或者GvHD本身就比较低的γδT,iNKT或者CAR-NK疗法等。目前进展较快的通用型CAR-T疗法和CAR-NK疗法都已经进入临床,但是在肿瘤的治疗中,这些疗法相较于传统的自体CAR疗效都不尽人意。
Allogene的ALLO501A是首个进入关键临床的同种异体(allogeneic)细胞疗法。2023 ASCO会议期间更新了ALLO-501A早期临床结果:
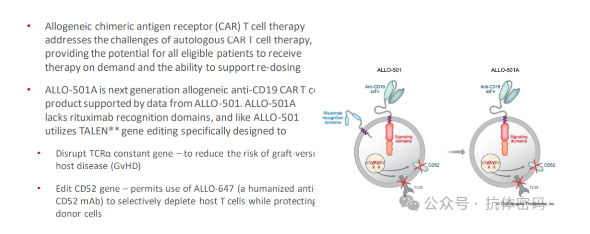
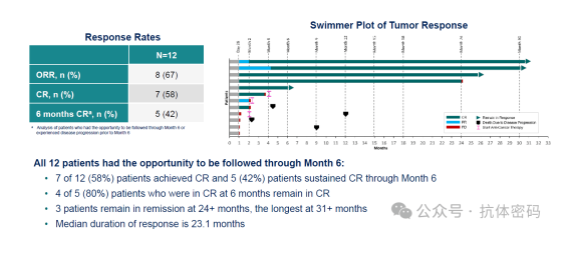
本次公布的一期临床120-360 x 106剂量组的数据,相较于早期数据,疗效有所提升,其响应率ORR=67%,CR=58%,疗效尚可。对比吉利德的Yescarta 在ZUMA-7研究中的ORR和CR分别是83%和65%、BMS的自体CAR-T Breyanzi在末线LBCL多个临床研究中ORR都超过70%,CR则超过50%。而且目前其临床患者数量较少,随着患者增多,总体疗法肯定会有下降。
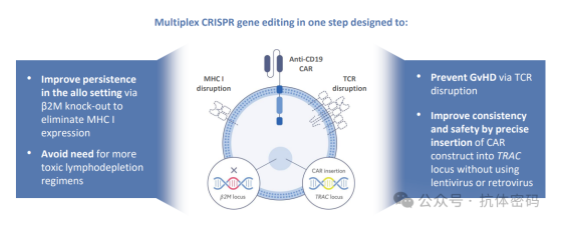
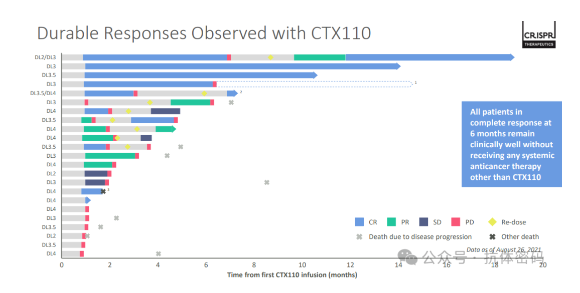
另外再看一下CRISPR的CTX110。CTX110是一款利用CRISPR基因编辑技术改造的同种异体CAR-T疗法,将靶向CD19抗原的嵌合抗原受体定位敲入细胞的天然T细胞受体位点,同时使用CRISPR技术消除TCR,以防止GvHD的产生
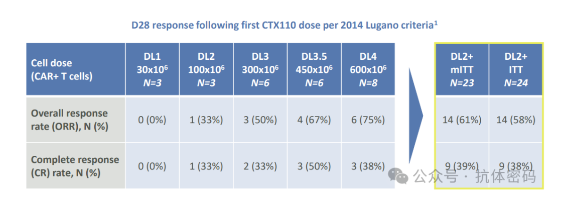
CTX110在治疗既往至少接受2L治疗的LBCL患者(排除CAR-T治疗患者)的临床中,DL2以上剂量23例患者中ORR=61%,CR=39%。
在疗效维持方面:CTX110部分患实现了长久的反应,但是多数患者在6个月内复发,甚至短的在2个月左右就开始复发。虽然部分患者在再次给药后能达到PR或者CR,但是还是有多数在治疗不久后复发。因此,整体看来,CTX110在疗效维持上和自体CAR-T疗法还有较大差距,而且在CRISPR的官网,目前已经看不到CTX110的身影。
看完CAR-T领域,我们再看看CAR-NK领域,作为NK疗法的领头羊,Fate Therapeutics曾经辉煌一时,2020年4月,Fate Therapeutics与强生达成合作,并一跃成为资本宠儿,多家投资巨头争相跟进,股价一度高达121美元,市值超100亿美元。此时其最快的CAR-NK疗法FT516和FT596已经进入临床。
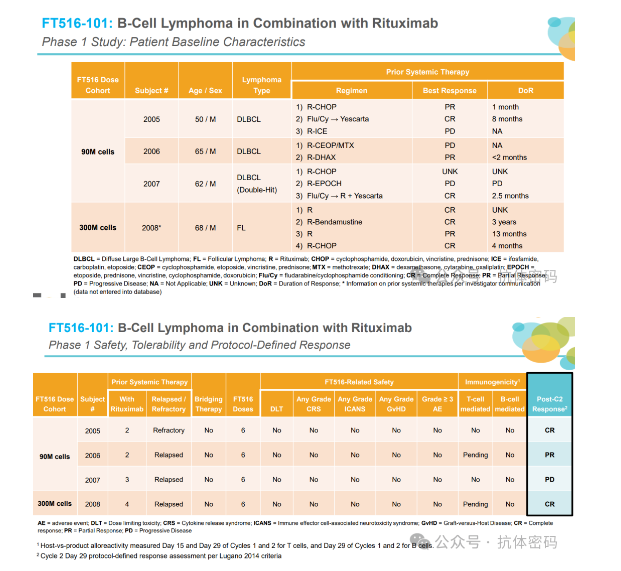
2021年FT516和FT596相关临床结果陆续出炉,FT516和利妥昔单抗联合,初步展现了良好的疗效,在2021年6月4日的公告中,FT516联合利妥昔单抗治疗r/r BCL患者中的临床中,11名接受治疗患者中,ORR=73%,CRR=55%,安全性良好,未观察到GvHD与相关SAEs。
但是随后更新的患者治疗后病情进展数据,FT516治疗后在8例OR患者中,5例持续响应mOS=5.2个月;另有2例CR患者再次复发、1名PR患者接受其他治疗,总体疗效不及CAR-T疗法。另外一个项目FT596遭遇了同样的问题,因此后续Fate Therapeutics股价持续下跌,目前这两个项目已经消失在其管线中。
遭遇相同问题的还有Nkarta,2023 年 6,Nkarta 公布了其同种异体、现货CAR-NK细胞疗法NKX101的Ⅰ期临床研究数据,用于治疗复发或难治性 (r/r) 急性髓系白血病 (AML) 患者。NKX101是使用从健康供体中获得的外周血NK细胞,并利用生物工程添加CAR。其靶向肿瘤表面的NKG2D配体,NKG2D是NK细胞的关键性激活受体,其配体在癌症细胞中过度表达。
之前公布的数据显示,接受3剂1B或1.5 B NK细胞治疗的 5 名患者中,有 3 人清除了癌细胞,但后续更新的数据显示其中两名患者仅在几个月后再次复发。这也表明,和Fate Therapeutics的通用型CAR-NK疗法一样--无法像CAR-T疗法一样,早期的OR或者CR并不能转化成PFS或者OS。

当然,NK相干疗法在肿瘤中也不是一无是处,Affimed基于双抗和NK细胞联合的ICE®疗法无论是在血液瘤还是在实体瘤中都展现了良好的疗效。
东边不亮西边亮,虽然通用型细胞疗法在肿瘤治疗领域举步维艰,但是在自免赛道,最近的相关进展让各大公司燃起了新的希望。
在今年的美国风湿病学会年会(ACR)上,恩瑞恺诺公布了其CD19 CAR-NK疗法治疗复发性系统性红斑狼疮的临床数据。临床结果表明,20位重度复发性系统性红斑狼疮患者接受了3个剂量的CD19 CAR-NK治疗。安全性方面,只观察到2例患者出现1级CRS(短暂发热),没有其他副作用和感染事件。有效性方面,对于8例随访6个月以上的患者,4例(50%)达到DORIS缓解,6例(75%)达到LLDAS(低狼疮疾病活动度)。

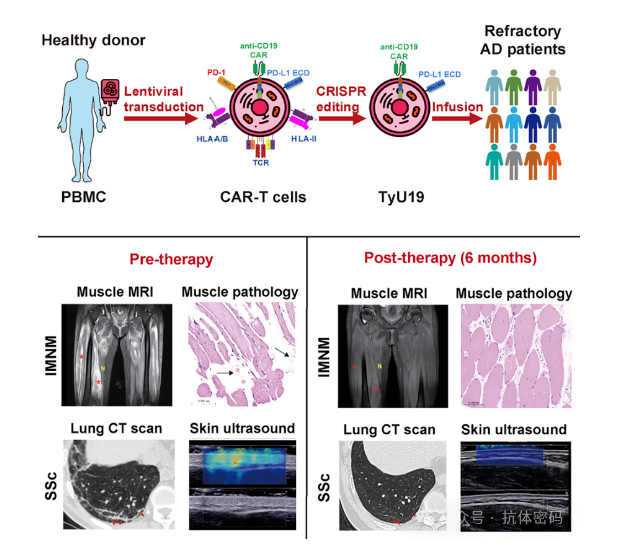
通用型CAR-T治疗免疫疾病方面,邦耀生物今年7月份在Cell杂志上发表了其通用型CAR-T疗法TyU19在治疗自身免疫疾病研究成果。TyU19是一种“off-the-shelf”CAR-T细胞治疗产品,即将来自健康人体的T细胞制备成靶向CD19的CAR-T细胞后,通过CRISPR-Cas9基因编辑技术敲除HLA-A、HLA-B、CIITA、TRAC和PD-1等基因,解决异体CAR-T疗法中免疫排斥的问题。
TyU19用于治疗1例难治性免疫介导性坏死性肌病(SPR-IMNM)患者和2例弥漫性皮肤系统性硬化症(dcSSc)患者,输注的TyU19在体内持续存在超过3个月,实现了完全B细胞耗竭。在6个月的随访期内,患者未出现细胞因子释放综合征或其他严重不良事件,相应疾病的临床反应指数评分显著改善,达到深度缓解。
总结
已经进入临床的通用型细胞疗法虽然在初期取得了不错的疗效,但是后续随着时间推移,基本上多数都会在短时间内复发,患者并不能真正的受益。其可能有多方面的原因,一方面,肿瘤微环境整体上处于免疫抑制状态,初期激活的细胞后续可能会慢慢被抑制,另外一方面,通用型细胞疗法在体内的持久性可能不如自体细胞疗法,这会导致后期免疫细胞数量不足,并进一步导致肿瘤的复发。
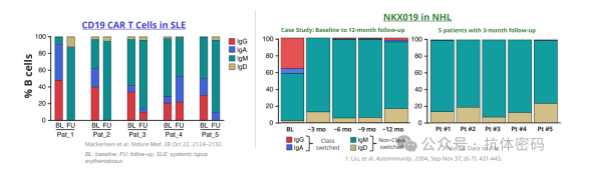
而在自免领域,机体整体上不像肿瘤处于免疫抑制状态,因此其活性可能不会受到抑制。另外,自免治疗的机制不同于肿瘤,自免只是需要清除对自身抗原有免疫的免疫细胞,后续再生的免疫细胞可能不会对机体造成伤害,这一点在多个通用型疗法中也逐渐得到一定程度的证明,如Nkarta的研究表明,通用型细胞疗法NKX019在NHL治疗中,随后长达12月的时间里,患者重建的B细胞基本上都是原始的IgM或者IgD。
今年,TCE双抗自免领域交易不断,这在一定程度上也会促进通用型细胞疗法向该领域的快速转型。之前布局通用型细胞疗法的公司,现在基本上都已经在布局自免相关领域的管线。而且近日Poseida Therapeutics被罗氏以15亿美元收购,或许会开启MNC并购通用型细胞疗法公司的新热潮。




