至今,免疫疗法在对抗肿瘤的策略中,相较于传统方法,展现出了巨大的潜力,特别是在全身性治疗方面。单克隆抗体,凭借其对特定分子的精准作用,已成为抗癌治疗中不可或缺的有效手段。尽管如此,鉴于肿瘤病理机制的复杂性,单一靶点的单克隆抗体在疗效上可能并不充分。正是基于这一点,能够同时作用于多个靶点的双特异性抗体(bsAbs)应运而生,其创新为肿瘤免疫治疗领域带来了革命性的变化。
目前,科研人员正致力于开发多种新型的双特异性抗体(bsAbs),以应对癌症治疗的挑战。这些创新的抗体包括能够同时针对肿瘤生长、血管生成和转移过程的双重靶向抑制剂。此外,还有抗体药物偶联物、T细胞导向的抗体、双特异性自然杀伤细胞接合器(NKCE)以及先天免疫细胞激活剂。在这一领域,还包括了具有双重功能的双特异性免疫检查点抑制剂(CPI)、能够同时提供免疫刺激和抑制的bsAbs,以及在肿瘤微环境中特异性激活的抗体。最新的研究还探索了将T细胞转移疗法与治疗性抗体相结合的策略。
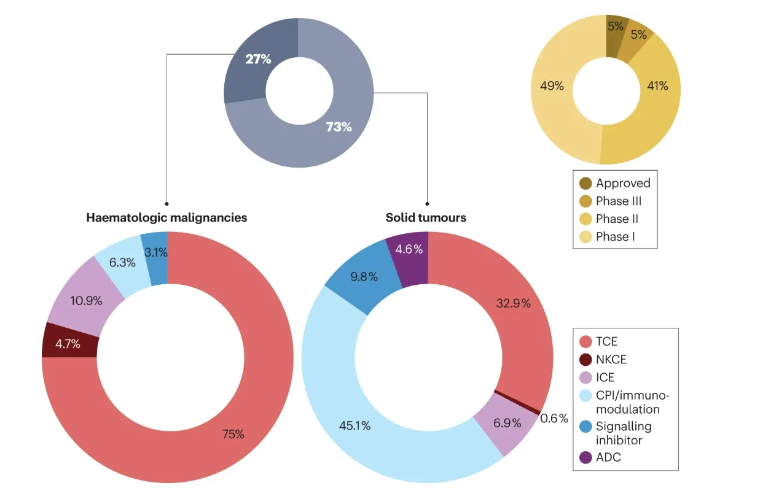
当前,超过300项临床研究正在评估超过200种独特的双特异性抗体,这些研究中大约四分之三专注于实体肿瘤的治疗,而剩余的四分之一则针对血液恶性肿瘤。迄今为止,已有10种双特异性抗体药物获得批准用于抗癌治疗,其中9种已在美国和/或欧洲市场上市,而cadonilimab则是在中国获批。在这些临床研究中,大部分处于较为成熟的阶段,即第二阶段和第三阶段。值得注意的是,在针对实体肿瘤的双特异性抗体中,免疫调节剂占据了主导地位,具体包括双重免疫检查点抑制剂(约占45%)和T细胞接合剂(约占33%),此外还有针对双重信号通路、免疫细胞接合剂(ICEs)和抗体药物偶联物(ADC)的双特异性抗体。最初,Alfred Nisonof 在20世纪60年代提出了双特异性抗体(BsAbs)的概念。他通过将两种不同的抗原结合位点融合在单一分子中,成功从特定抗体片段的混合物中获得了具有双重特异性的F(ab’)2分子。1975年,Köhler和Milstein发明的杂交瘤技术,为单克隆抗体的大规模生产提供了解决方案,这标志着单克隆抗体治疗的新纪元。十年后,Milstein和Cuello通过quadroma技术,基于两种分泌不同抗体的杂交瘤细胞系的融合,进一步推动了具有双重特异性的鼠IgG形式的双特异性抗体的发展。尽管如此,bsAb的产量较低,且从相似的副产物中分离出所需的抗体存在挑战。1988年,James Huston及其团队开发了单链抗体片段(scFv),这一创新显著降低了复性过程中可能出现的问题,如结构域的错误配对或聚集。1996年,Genentech的科学家们利用重组DNA技术,发明了knob-into-hole技术,有效解决了quadroma技术的局限。通过在人类IgG的CH3结构域界面上引入特定的突变,减少了重链的错配,从而促进了高达90%的正确双特异性重链配对的形成。随着抗体工程和生物学技术的不断进步,双特异性抗体的概念和结构也在不断地演化和完善。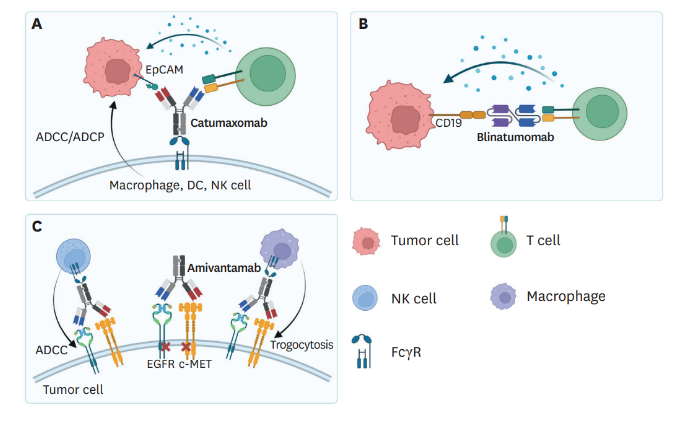
靶向双受体抑制的bsAb细胞信号传导过程中的表面蛋白,例如受体酪氨酸激酶(RTK)及其相关受体,是抗体治疗的潜在靶点。尽管针对特定信号受体的抗体治疗显示出显著的疗效,但疾病相关表型往往由多条信号通路共同作用引发。这种信号通路的冗余性使得细胞能够通过激活替代的补偿性信号途径,从而抵抗药物引起的生长抑制或细胞毒性。双特异性抗体能够同时调节多个与疾病相关的信号受体或通路,从而降低或克服这种耐受性。例如,Amivantamab(商品名JNJ-61186372)能够同时靶向表皮生长因子受体(EGFR)和肝细胞生长因子受体(MET),这两种受体均与非小细胞肺癌(NSCLC)的增殖密切相关。研究表明,同时阻断这两个受体比单一途径阻断更能有效地抑制NSCLC的生长。Amivantamab已获得美国食品药品监督管理局(FDA)的批准,用于治疗携带EGFR外显子20插入突变的NSCLC患者。一项III期临床试验的结果显示,Amivantamab联合化疗在这部分患者中相较于单纯化疗表现出显著的疗效优势。此外,其他针对肿瘤不同第二靶点的EGFR双特异性抗体也在临床开发阶段。例如,Petosemtamab(MCLA-158)能够同时靶向EGFR和LGR5,后者是一种与癌症干细胞相关的细胞表面受体。目前,Petosemtamab正在针对包括晚期头颈部鳞状细胞癌在内的实体瘤患者进行I/II期临床试验(NCT03526835)。双特异性抗体具有同时阻断两种不同配体或配体与受体组合的能力。例如,它们可以同时针对血管内皮生长因子(VEGF)和血管生成素2(ANG2),这两种因子都参与了血管生成过程。Vanucizumab是一种能够同时靶向VEGFA和ANG2的双特异性抗体,在临床前模型中,与化疗联合使用时展现出了抗肿瘤、抗血管生成和抗转移的效果。BI836880是一种三特异性纳米抗体融合蛋白,由针对VEGFA、ANG2和人血清白蛋白(HSA)的三个纳米抗体组成,后者有助于延长其在血清中的半衰期。目前,BI836880正在头颈部鳞状细胞癌、非小细胞肺癌(NSCLC)和其他实体瘤患者的I期临床研究中进行评估。此外,靶向VEGF的bsAbs还可以进一步设计为同时靶向肿瘤细胞上的PD-L1或T细胞上的PD-1,将抗血管生成策略与肿瘤免疫治疗相结合。例如,ivonescimab(AK112),一种同时靶向PD-1和VEGF的双特异性抗体,已在中国获得批准用于治疗某些肿瘤。PM8002是另一种靶向PD-L1和VEGF的双特异性抗体,目前正在进行针对非小细胞肺癌患者的II/III期临床研究(NCT05756972)。激活细胞表面受体是促进抗肿瘤反应的关键机制之一,这可以通过免疫反应诱导细胞凋亡或死亡来实现。一种策略是将生长因子、细胞因子或免疫刺激配体等受体激活配体融合到抗体或其片段中,以实现局部或组织特异性的激动活性,进而激发细胞反应。目前,越来越多的这类抗体-配体融合蛋白正在进行临床试验评估。激动性抗体也是实现受体激活的另一种方法。双特异性抗体,特别是那些针对肿瘤坏死因子超家族(TNFRSF)成员的抗体,已被证实是具有显著活性和肿瘤选择性的激动剂。例如,RG7386(RO6874813)是一种四价双特异性抗体,它靶向癌症相关成纤维细胞上的FAPα和DR5,在小鼠模型中显示出有效且选择性的肿瘤细胞杀伤作用,并已经进入临床测试阶段。此外,BI905711,一种同时靶向DR5和CDH17的四价双特异性IgG-scFv融合蛋白,目前正在进行I期临床研究。bsAbs在靶向递送治疗有效载荷,例如细胞毒性药物或放射性药物方面,展现了两种概念上不同的策略。第一种策略称为预靶向治疗,它利用bsAb的一个臂来特异性地结合肿瘤细胞,而另一个臂则用于捕获并递送有效载荷。例如,GD2 x DOTA是一种bsAb,能够识别GD2并捕获放射性有效载荷177Lu-DOTA,实现在肿瘤微环境中(TME)的有效组装。然而,由于半衰期的限制,这种预靶向方法在没有四聚化的情况下会迅速从体内清除。尽管如此,目前在临床试验中应用这种作用机制(MoA)的bsAbs仍然较少,这可能是因为放射性预靶向的复杂导流过程限制了其广泛应用。第二种策略通过将细胞毒性有效载荷直接偶联到bsAb上,实现对肿瘤细胞的特异性靶向。这种方法使得bsADC(双特异性抗体药物偶联物)成为肿瘤药物开发领域的热点,已有多种bsADC进入临床开发阶段,例如ZW49、REGN5093和BL-B01D1等。癌症免疫疗法中使用的大多数bsAbs通过T细胞驱动的天然或内源性免疫发挥作用,包括免疫检查点抑制(CPIs)效应细胞接合器(包括TCE和ICEs)以及共刺激性bsAb。
免疫检查点抑制剂,如针对CTLA4或PD-1/PD-L1的单特异性抗体,已在癌症免疫治疗中得到广泛应用。将这一治疗策略扩展至双特异性抗体(bsAbs)领域,有望降低不良副作用的同时提升治疗效果。目前,许多双免疫检查点抑制剂主要针对PD-1/PD-L1信号通路以及其他免疫抑制分子,包括CTLA-4、TIM-3、LAG-3和TIGIT。MEDI5752,一种PD-1与CTLA-4的双特异性抗体,能够抑制PD-1阳性T细胞中的CTLA-4功能,并通过诱导PD-1的快速内化和降解来增强疗效。与单独使用PD-1和CTLA-4单克隆抗体相比,MEDI5752显示出了显著增强的活性。此外,针对LAG-3和TIGIT等其他免疫检查点分子的双功能性抑制剂也在积极研发之中。






