免疫细胞因子的进展和挑战:对抗癌症的新方向
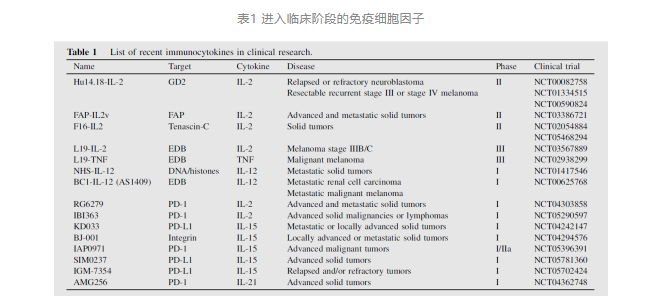
免疫细胞因子,又称抗体-细胞因子融合蛋白,通过靶向性抗体将免疫激活性的细胞因子直接递送至肿瘤局部,并同时阻断免疫检查点或肿瘤特异性抗原。这一策略不仅能够延长细胞因子的半衰期、降低其毒副作用,还能诱导更强的抗肿瘤免疫反应,相较于传统的抗体与细胞因子联合用药具有明显优势。近年来,免疫细胞因子成为研究热点,国内外制药企业积极布局,目前已有多个分子进入临床试验阶段(详见表1,数据来源于clinicalTrials网站公开信息)。
近日,上海交通大学药学院路慧丽团队在药学领域权威杂志《Acta Pharmaceutica Sinica B》上发表了题为“Advancements and challenges in immunocytokines: A new arsenal against cancer”的综述文章,概述了免疫细胞因子在肿瘤治疗领域中的研究进展,强调了靶向PD-1等检查点的免疫细胞因子在抗肿瘤中的优势,解析了IL-2、IL-12、IL-15等热门细胞因子的研发进展和机制,展示了IL-10、IL-18和IL-24等新型细胞因子用在构建免疫细胞因子方面的潜力。本文还聚焦于免疫细胞因子的安全性挑战,系统总结了下一代免疫细胞因子的潜在开发策略,为免疫细胞因子的开发与应用提供了参考。

近年来,基于PD-1抗体的免疫细胞因子吸引了越来越多的关注。通过利用PD-1抗体将细胞因子直接顺式递呈给肿瘤微环境中的PD-1+CD8+ T细胞,使细胞因子能够直接作用于CD8+ T细胞,从而显著增强抗肿瘤效应。罗氏公司开发的PD1-IL-2v (所用IL-2突变体为IL-2Rβγ偏向性激动剂)能够在不结合CD25的情况下促进干细胞样CD8+ T细胞分化为具有更强效应功能的CD8+ T细胞,展现出卓越的抗肿瘤疗效。信达生物开发的IBI363(PD-1/IL-2Rα)研究表明,与IL-2Rβγ偏向性激动剂相比,IL-2Rα偏向性激动剂能够有效扩增肿瘤特异性PD-1+CD25+CD8+ TILs,增强抗肿瘤作用。此外, IL-2Rα偏向性激动剂对外周Tregs具有更强的刺激作用,因此其安全性优于IL-2Rβγ偏向性激动剂。临床试验结果显示IBI363在晚期非小细胞肺癌和黑色素瘤患者中表现出令人鼓舞的疗效,并且耐受性良好。
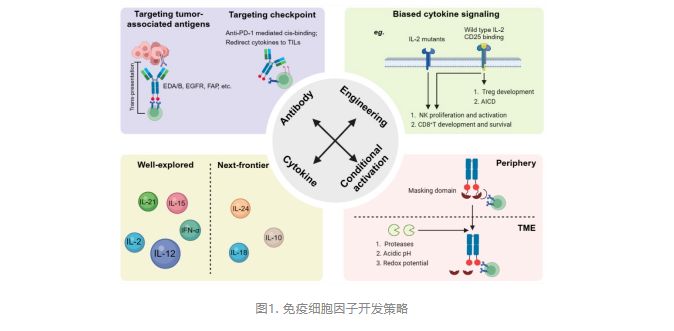
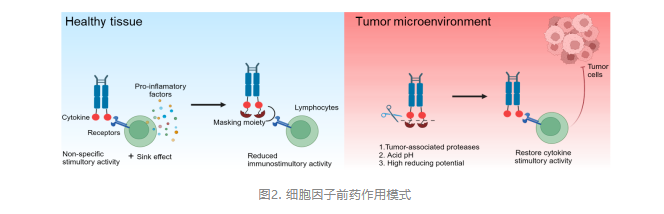
然而,对于大多数在研的免疫细胞因子而言,对细胞因子的肿瘤靶向性提升程度有限,仅有一小部分免疫细胞因子能够被肿瘤部位有效摄取,而大部分仍然存在于外周循环中。由于细胞因子内源性受体的广泛表达,这些免疫细胞因子作用于非靶细胞时仍会引发不良反应。为解决免疫细胞因子的成药性困难,研究人员开发了多种策略,其中细胞因子工程化改造和细胞因子前药设计是两种最有效的方案。对免疫细胞因子的细胞因子部分进行工程化改造,降低其对内源性受体的亲和力,不仅可以降低外周清除率,还能够进一步提高肿瘤靶向能力从而减轻毒副作用。此外,前药策略也为解决该问题提供了思路。在肿瘤微环境中选择性地“打开”细胞因子活性、在正常组织中“关闭”其活性,理论上能够降低细胞因子的系统性毒副作用,同时保持抗肿瘤活性并改善代谢性质。细胞因子前药的设计关键在于细胞因子活性的掩蔽技术,作者团队曾首次报道空间位阻掩蔽策略,并设计了一系列基于IL-15的免疫细胞因子前药,在不引入额外掩蔽基团的情况下成功实现了对细胞因子活性的掩蔽和调控。其中,关于anti-PD-L1/IL-15前药相关研究已发表在国际知名期刊《Cell Reports Medicine》上。
文章最后,作者总结并展望了下一代免疫细胞因子的开发思路,关于如何选择抗体和细胞因子,一个重要的标准就是抗体与细胞因子的“融合”应优于“联合”;在改善安全性方面,工程化改造和前药设计被认为是两种有效的策略;为了进一步增强抗肿瘤作用,联合其他疗法或抗体携带不同的细胞因子均是有效的方案。
上海交通大学药学院史文强博士后和中科院上海药物所刘楠博士后为该文章的共同第一作者,上海交通大学药学院路慧丽副研究员为通讯作者。该团队长期聚焦抗体、细胞因子及细胞治疗等创新免疫治疗药物的研发,尤其在IL-15成药性研究方面取得了多项重要成果。本工作得到了上海市科委及重庆市自然科学基金等项目的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2211383524003149




