目前对 CAR T 细胞相关毒性的理解和管理
学习Nat Rev Clin Oncol最新发表的一篇综述,了解目前对CART细胞相关毒性的理解和管理。
CAR T细胞相关的毒性,如细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),已经被广泛认识,并且通过免疫抑制剂的改善支持性护理和管理,使得CART细胞疗法比2017年首次获得监管批准时更安全、更可行。
随着这些疗法的临床经验不断增加,也提高了对以前定义不太明确的毒性的认识,包括运动障碍、免疫效应细胞相关血液毒性(ICAHT)和免疫效应细胞相关噬血细胞性淋巴组织细胞增多症样综合征(IEC-HS),以及由于持续B细胞再生障碍和低丙种球蛋白血症而带来的感染风险。
随着针对新抗原的CAR T细胞产品的开发,涉及对表达目标抗原的正常组织造成损害的毒性是一个潜在的障碍。这篇综述中讨论了CAR T细胞相关毒性的不断发展的理解和临床管理。
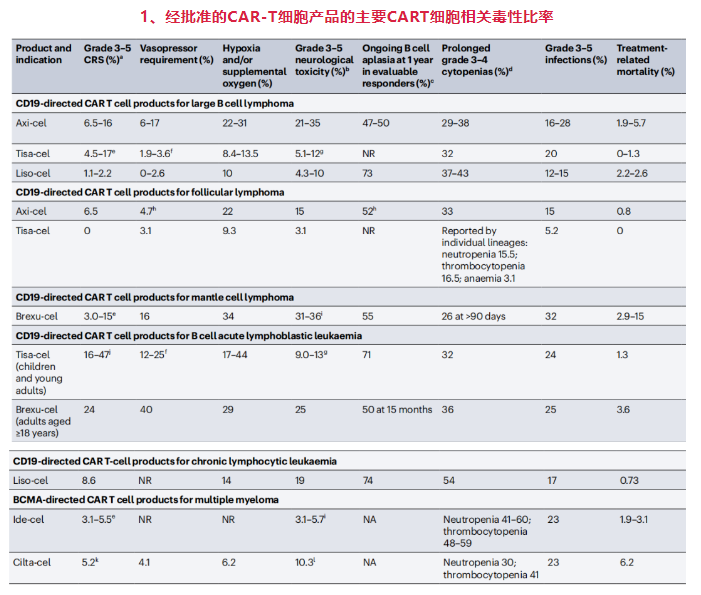
CD19靶向大B细胞淋巴瘤产品:Axi-cel、Tisa-cel、Liso-cel
CD19靶向滤泡淋巴瘤产品:Axi-cel、Tisa-cel
CD19靶向套细胞淋巴瘤产品:Brexu-cel
CD19靶向急性B淋巴细胞白血病产品:Tisa-cel(children and young adults)、Brexu-cel (adults aged ≥18 years)
CD19靶向慢性淋巴细胞白血病产品:Liso-cel
BCMA靶向多发性骨髓瘤产品:Ide-cel、Cilta-cel
表格中详细展示了6个已获批产品在不同适应症中≥3级CRS、升压药使用、低氧、≥3级神经毒性、B细胞再生障碍、延长的≥3级血细胞减少、≥3级感染、治疗相关死亡的发生率。
CRS:是CAR-T细胞疗法中最常见的严重不良事件之一,其特点是大量炎症性细胞因子的快速释放,如IL-6、IFNγ和IL-2。CRS可能导致高热、低血压、缺氧、呼吸衰竭,甚至多器官功能衰竭,这些情况都可能危及生命。CRS通常在CAR T细胞输注后的14天内发生,中位发病时间为2-7天。严重CRS可能在输注后仅几小时内开始。发热通常是CRS的首发症状。
免疫效应细胞相关噬血细胞性淋巴组织细胞增多症样综合征(IEC-HS):这是一种类似噬血细胞性淋巴组织细胞增多症的高炎症综合征,可能在CRS之后发生,表现为血清铁蛋白水平极度升高等症状。
ICANS:是CAR-T细胞疗法中的另一种严重不良事件,表现为脑病、意识障碍、癫痫发作等神经系统症状,严重时可导致死亡。ICANS通常与CRS同时或稍后发生,神经系统症状的多样性包括脑病、语言障碍和意识水平的不同程度下降。
BCMA靶向CART细胞治疗后的运动障碍:在BCMA CAR-T细胞治疗后,患者可能出现的不典型延迟性神经系统综合征,包括帕金森病样症状(parkinsonism),表现为运动功能障碍,如震颤、运动迟缓、肌张力增高等。通常在治疗后有一定的延迟发作,可能在输注后的几周或几个月内出现。
免疫效应细胞相关血液毒性(ICAHT):与CART细胞治疗相关的骨髓抑制可能导致持续性的高级别血细胞减少,尤其是中性粒细胞和血小板。
B细胞再生障碍、低丙种球蛋白血症和感染:由于CART细胞治疗可能导致长期的B细胞缺失,这会影响患者的免疫反应。
第二恶性肿瘤:CAR T细胞治疗后也有报告发生第二恶性肿瘤的风险,但这种情况罕见。以下是相关第二肿瘤的调研:
1:N Engl J Med. 2024;390(7):584-586.2024年2月新英格兰发表的关于第二肿瘤的文章,截至2023年12月31日,接受六种获批产品治疗的患者约27,000例,FDA收到了22例(0.08%)接受CAR-T治疗后发生T细胞癌症的病例,其中包括T细胞淋巴瘤、T细胞大颗粒淋巴细胞症、外周T细胞淋巴瘤和皮肤T细胞淋巴瘤。
2:N Engl J Med. 2021;384(7):673-674:随访5年,38例患者中有6例(16%)发生了第二肿瘤,2例(5%)肺癌,1例(3%)ALL,1例(3%)骨髓增生异常,1例(3%)前列腺癌,1例(3%)黑色素瘤,未发现具有复制能力的慢病毒病例。
3:N Engl J Med. 2022;386(7):640-654:随访18M接受治疗的179例患者均未发生第二肿瘤。
4:J Clin Oncol. 2020;38(32):3805-3815:随访5年,43例患者中有7例(16.3%)在治疗后出现了第二肿瘤。
5:Biol Blood Marrow Transplant. 2020;26(1):26-33:随访2年,86例患者中13例(15%)患者发生了第二肿瘤:6例(7%)非黑色素瘤皮肤癌,4例(5%)MDS,1例(1%)黑色素瘤,1例(1%)非浸润性膀胱癌和1例(1%)多发性骨髓瘤。
6:J Hematol Oncol. 2022;15(1):86:74名RR MM患者接受了LCAR-B38M治疗,4例(5.4%)发生非血液学第二肿瘤,未检测到骨髓瘤细胞,认为第二肿瘤与LCAR-B38M无关。
CRS的危险因素包括恶性肿瘤的高肿瘤负荷、ECOG体能状态差、治疗前血清炎症标志物升高、基线低血小板计数、接受和/或需要桥接治疗、强化清淋化疗、高CAR-T细胞剂量和高CAR-T细胞峰值血液水平。目前已开发出多种风险分层模型来预测严重CRS的发生,它们通常包括清淋前实验室测试值和/或CAR-T细胞输注后血清中细胞因子或其他免疫蛋白的早期水平,如C反应蛋白、铁蛋白等。
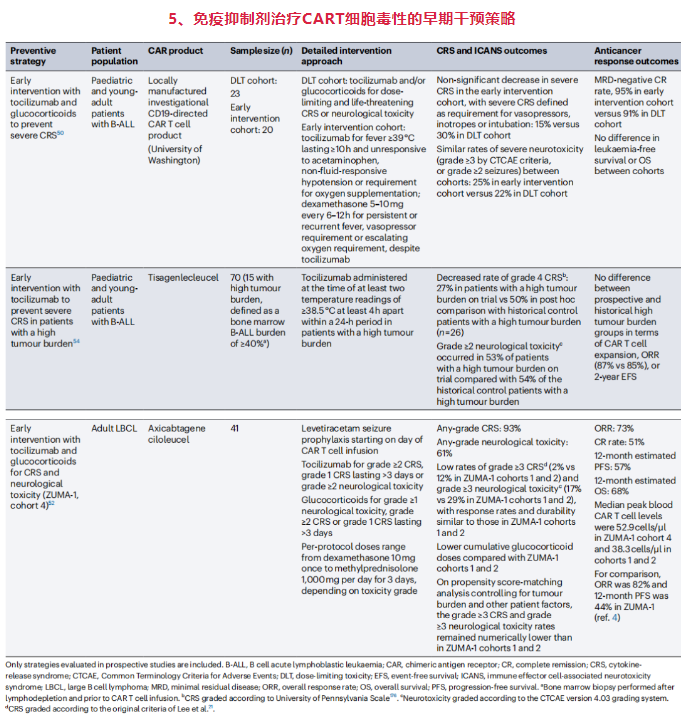
随着CAR-T细胞相关毒性的早期干预,高级别不良事件的发生率有所降低。例如在101例LBCL患者的II期ZUMA-1研究中,≥3级CRS和神经毒性的发生率均降低,可能部分归因于方案修订,允许更早给予托珠单抗或糖皮质激素。托珠单抗和糖皮质激素预防性和(或)早期干预对降低高级别CRS的发生率有一定疗效,而对缓解率、缓解持久性或血液CAR-T细胞水平无明显不利影响。
CAR-T细胞具有极好的穿透血脑屏障(BBB)和进入脑脊液(CSF)的能力,神经毒性仍是CAR-T细胞治疗的主要问题和障碍。
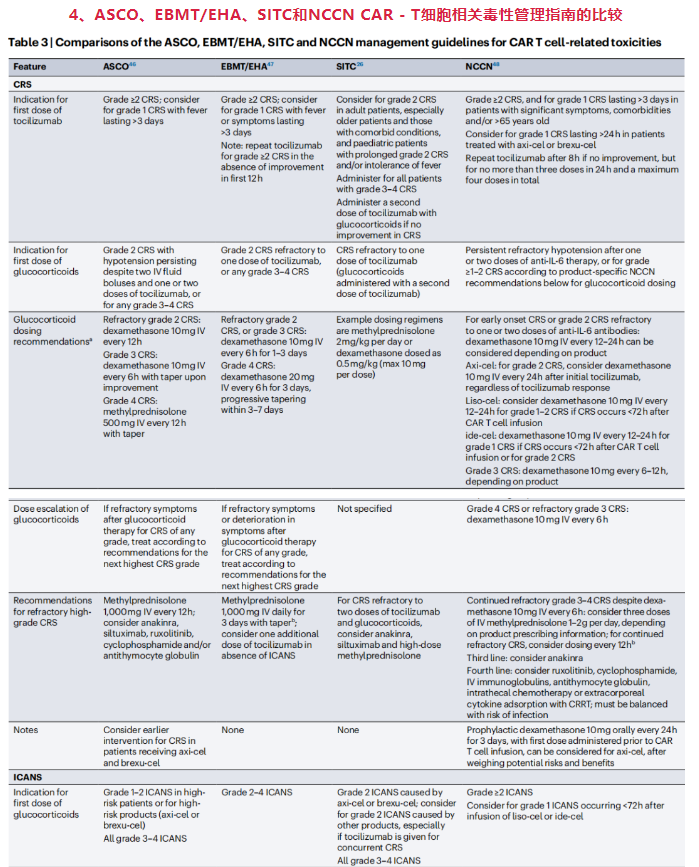
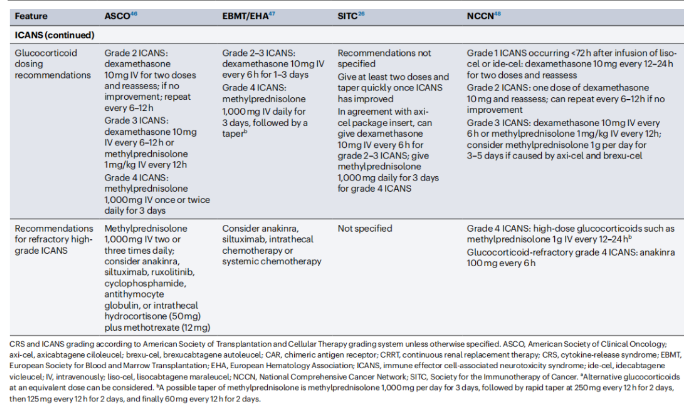
CRS与ICANS同时发生的情况下需要谨慎管理,需参考ASCO和NCCN共识建议中的具体指南。
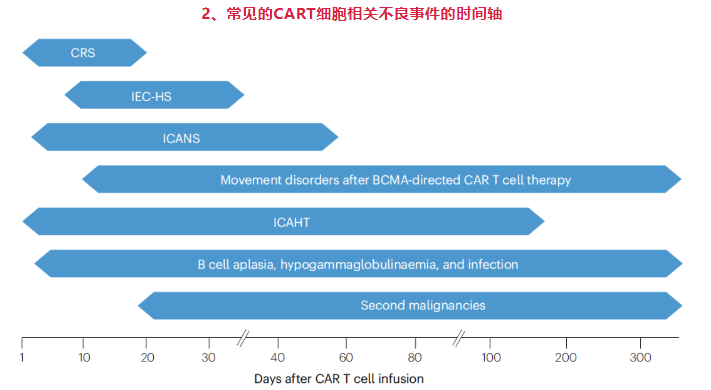
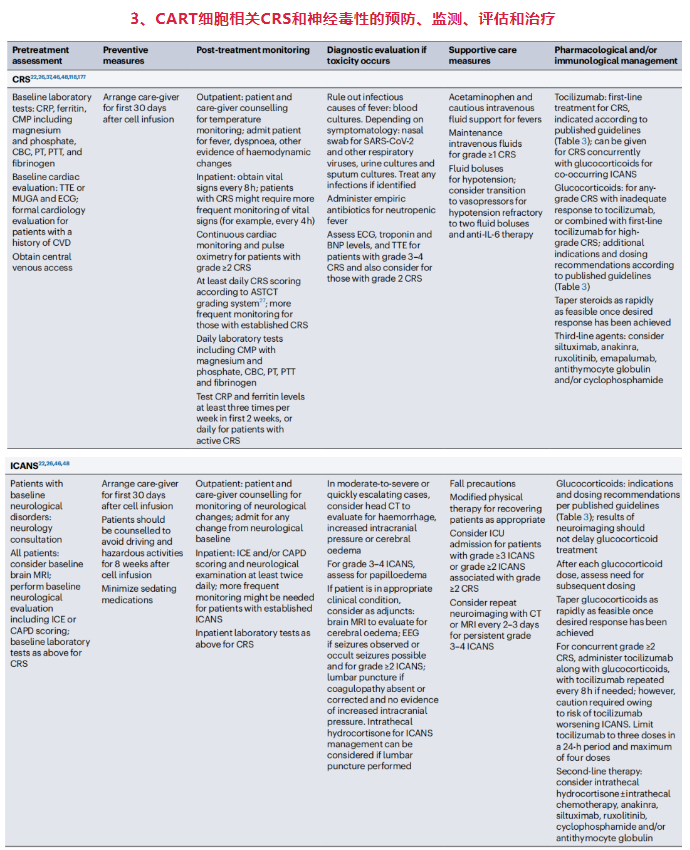
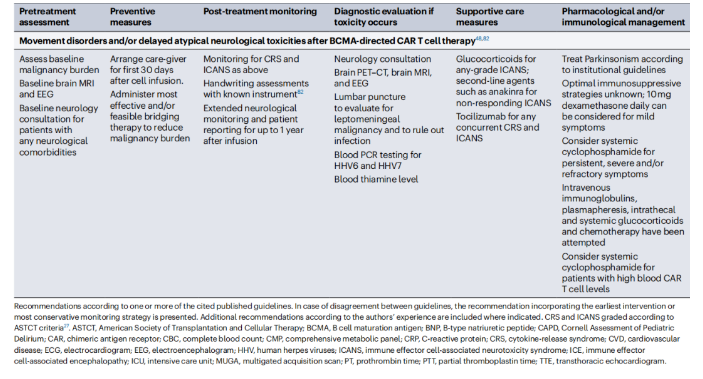
6、CART细胞相关血液学和免疫毒性的预防、监测、评估和治疗
CAR-T 治疗后发生的血细胞减少目前被 EHA 和 EBMT 称为免疫效应细胞相关血液毒性 (ICAHT)。
骨髓抑制:3级或以上的血细胞减少在清淋化疗后的头几天至一个月内非常普遍。中性粒细胞减少症与CRS同时发生,常常导致中性粒细胞减少性发热,这种在接受CAR-T细胞治疗的患者中报告的比例在2-36%之间。
持续的高级别血细胞减少:持续时间较长的3级或以上血细胞减少也常见于针对B细胞和浆细胞的CAR-T细胞产品。此外,有小部分患者在CD19靶向CAR-T细胞输注后报告了持续六个月以上的3-4级血细胞减少(主要是中性粒细胞减少和血小板减少)。CD19 CAR-T 细胞输注后持续>6个月的中性粒细胞减少和血小板减少报告率分别约为1-4%和0-6%。
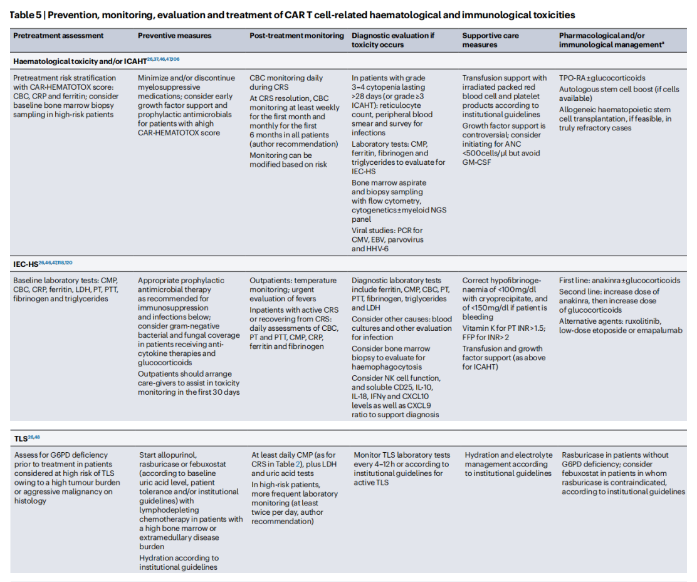

CAR-HEMATOTOX评分是一个5项工具,包括基线血红蛋白、血小板和中性粒细胞水平(与造血储备相关的标志物)以及炎症标志物铁蛋白和 CRP基线血清水平,可预测接受 CAR-T 细胞治疗的多发性骨髓瘤或各种淋巴瘤亚型患者的长期血液毒性和重度感染;因此,临床医生可考虑在 CAR-HEMATOTOX 评分较高的患者中进行基线骨髓活检、早期生长因子支持(从细胞输注后第2天左右开始),以及在中性粒细胞减少时开始对革兰氏阴性细菌和真菌感染进行抗菌预防。在 CAR-HEMATOTOX 评分较低的患者中,生长因子支持可延迟给药。
继发性HLH或IEC-HS
在接受 tisa-cel 治疗B-ALL、axi-cel治疗 LBCL 以及 ide-cel 或 cilta-cel 治疗多发性骨髓瘤的患者中报告了继发性嗜血细胞综合征HLH;在使用axi-cel、ide-cel和 cilta-cel 时还发生了罕见的致死性病例(发生率≤1%)。CAR-T相关HLH 是一种危及生命的巨噬细胞活化高炎症综合征,表现为血清铁蛋白水平高度升高、高甘油三酯血症、血细胞减少、凝血障碍、肺功能受损和肾和/或肝功能障碍。
感染
CAR-T 细胞治疗后常见≥3级细菌、病毒和真菌感染,估计有5-32%的患者发生。感染相关死亡是 CAR-T 细胞治疗后死亡的主要原因,中位随访持续10-16个月时为1-12%。CAR-T细胞治疗后感染的易感因素是多因素的,包括由清淋化疗诱导的CD4+ T细胞淋巴细胞减少(可持续>1年)、CD19 CAR-T 细胞引起的 B 细胞再生障碍、BCMA CAR-T 细胞引起的浆细胞耗竭、用于毒性管理的免疫抑制治疗以及与血液恶性肿瘤和既往癌症治疗相关的其他基础免疫缺陷。
托珠单抗是否增加接受 CAR-T 细胞治疗患者的感染风险的报道相互矛盾,其可能并非独立的风险因素。
on target off tumor毒性
因为正常组织可能的on target off tumor毒性,开发治疗 B 细胞和浆细胞恶性肿瘤以外的CAR-T 细胞疗法具有挑战性,例如GPRC5D在皮肤毛囊和硬角化上皮组织中也有低水平表达,GPRC5D CAR-T的预期毒性包括皮疹、指/趾甲变化等。
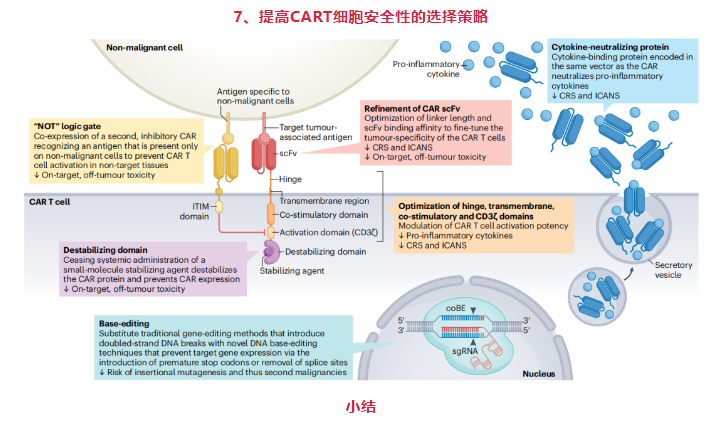
随着临床医生对CAR T细胞疗法的经验增加,CRS的管理已经改善,特别是使用IL-6受体拮抗剂托珠单抗。此外,通过改进支持性护理和使用糖皮质激素,ICANS的监测和治疗也有所改善。运动障碍(movement disorders)是BCMA靶向CAR T细胞的不常见并发症,难以管理,可能危及生命。持续性血细胞减少、继发性噬血细胞性淋巴组织细胞增多症和感染并发症越来越被广泛认识,并已制定了共识指南进行管理。在CAR T细胞疗法后报告了新的T细胞恶性肿瘤,但极为罕见。应无限期监测接受CAR T细胞疗法的患者是否出现第二恶性肿瘤。
这篇综述中有很多CAR-T相关毒性量化的数据可参考,在这儿只放了一部分,大家下载起来精读吧!
参考文献:
Brudno, Jennifer N, and James N Kochenderfer. “Current understanding and management of CAR T cell-associated toxicities.” Nature reviews. Clinical oncology vol. 21,7 (2024): 501-521. doi:10.1038/s41571-024-00903-0




