摘要:溶瘤病毒(Oncolytic Viruses, OVs)为对传统疗法抵抗的癌症患者提供了新颖且充满希望的治疗选择。天然或基因修饰的OVs是多方面的肿瘤杀手。它们直接裂解肿瘤细胞,同时保留正常细胞,并间接通过在肿瘤微环境(Tumor Microenvironment, TME)中释放抗原和激活炎症反应来增强抗肿瘤免疫。然而,一些限制,如OVs进入肿瘤的渗透性以及宿主的抗病毒免疫反应,正在阻碍溶瘤病毒治疗广泛转化为临床应用。如果这些挑战能够被克服,组合疗法,如OVs加免疫检查点阻断剂(Immune Checkpoint Blockades, ICBs)、嵌合抗原受体T细胞(CAR-T)或CAR自然杀伤(CAR-NK)细胞,将为临床提供强大的治疗平台。

病毒已被用作诱导细胞死亡和/或功能障碍的实验性制剂已有一百多年的历史。在1990年代,研究人员提出了一个假设:病毒能否被用来特异性地杀死肿瘤细胞?因此,溶瘤病毒(OVs)(见术语表)已被识别出来。OVs是选择性在肿瘤细胞内复制并被认为能诱导裂解以及免疫原性肿瘤细胞死亡的抗肿瘤剂。OV治疗与基因治疗的主要区别在于,后者使用的载体被设计为缺乏在感染细胞中复制的能力。OVs主要分为两组:天然存在的病毒和基因修饰病毒。天然存在的OVs,包括麻疹病毒(Measles Virus, MV)、新城疫病毒(Newcastle Disease Virus, NDV)和reovirus,已以其原生形式用于研究和临床试验。为了开发基因修饰OVs,移除了一些毒力基因以减弱病毒和/或将靶向转基因插入病毒基因组以促进抗肿瘤免疫。2015年,美国食品药品监督管理局(U.S. FDA)批准了首个OV(T-VEC)用于治疗转移性黑色素瘤患者。T-VEC是一种基因工程改造的溶瘤单纯疱疹病毒1型(oHSV-1),这是溶瘤病毒治疗领域的一个里程碑。2021年,日本批准了世界上首个针对恶性胶质瘤的OV(DELYTACT,oHSV-1带有G47Δ)。OVs作为单一疗法或与其他策略结合使用,得到了临床前和临床研究的支持。治疗效果取决于宿主的抗病毒反应与OV诱导的抗肿瘤免疫之间的平衡,但影响这种平衡的生物学机制仍然不清楚。在这里,我们描述了OVs的独特特性、天然和基因工程OVs的治疗潜力以及OV传递的有效给药途径。我们还讨论了随着OVs发展成为一类新的免疫治疗药物而出现的抗肿瘤活性和挑战。此外,我们强调了OVs与其他免疫疗法的组合如何可能克服成功癌症治疗的障碍。本综述旨在不仅阐明OV治疗的现状,而且指导设计更强大的治疗性OVs以治疗癌症患者。病毒是可以在宿主细胞内复制并诱导宿主炎症的小颗粒。主要有两种类型:DNA病毒和RNA病毒。DNA病毒通常具有较大的基因组,可以被编辑以编码转基因,以增加调节免疫系统或其他作用机制的治疗活性,而不影响病毒复制。RNA病毒的基因组比DNA病毒小得多,因此可以穿过血脑屏障(Blood-Brain Barrier, BBB)以靶向中枢神经系统(Central Nervous System, CNS)中的肿瘤细胞。然而,它们的小基因组限制了它们编码大型转基因的能力。此外,RNA病毒具有更高的遗传不稳定性,突变率远高于DNA病毒。在过去的十年中,已实验性地使用了DNA和RNA病毒的天然或工程化的OVs,并且一些已被带入临床(方框1)。我们调查了2012年至2022年的OV临床试验现状,并在表S1中总结了它们(见补充信息)。
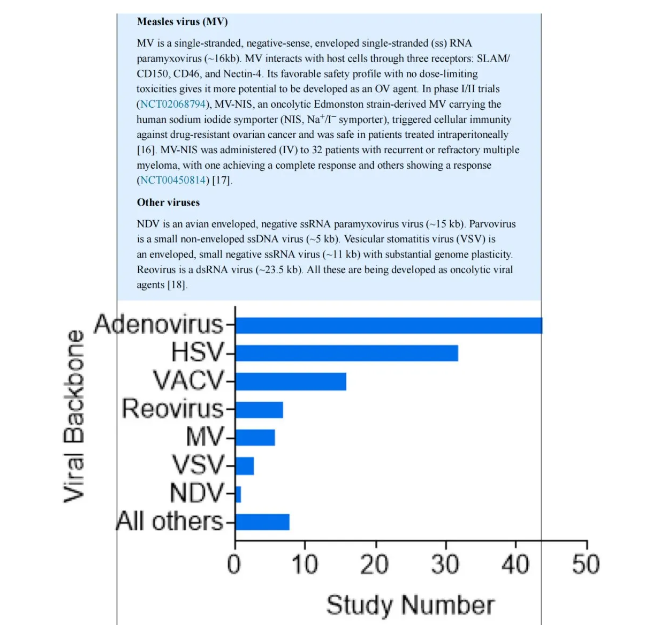
图I. 2012至2022年临床研究中正在研究的溶瘤病毒载体。用于临床试验的溶瘤病毒的特征。通过在ClinicalTrials.gov上搜索关键词:Oncolytic virus, Not recruiting (N/R), Active not recruiting (A/NR), Recruiting (R), 和 Completed (C),确定了2012年至2022年临床试验中报告的OVs类型。在结果中,腺病毒是最占优势的病毒载体(n = 44),HSV排在第二位(n = 32)。牛痘病毒(VACV)(n = 16)和其他几种病毒是为了比较而展示的。直接溶瘤活性,即直接裂解肿瘤细胞,是OVs杀死肿瘤的初始机制。然而,OVs也可以通过间接诱导系统性抗肿瘤免疫来发挥作用。OV感染的肿瘤细胞释放肿瘤抗原并激活炎症反应,可以抵消肿瘤诱导的免疫抑制和逃逸。几个因素推动了溶瘤病毒治疗中的肿瘤选择性。首先,通过病毒特异性受体进入细胞。肿瘤上SLAM/CD150和CD46受体的表达介导了溶瘤麻疹病毒(MV)的特异性识别。修改或突变病毒表面蛋白以识别肿瘤特异性细胞受体增强了OVs进入肿瘤细胞的能力。将OVs重新定向到肿瘤相关受体,包括表皮生长因子受体(EGFR),有助于有效的OV感染,从而改善病毒复制。其次,肿瘤细胞的分裂速度比正常静止细胞快,新陈代谢更高。因此,OVs利用肿瘤细胞的遗传机制进行复制是有利的。通过删除非必需的病毒毒力基因和插入肿瘤特异性启动子或结合microRNAs来工程化OVs,增强了OVs在肿瘤中的复制。第三,肿瘤细胞的免疫反应功能失调。抗病毒I型干扰素(IFN)信号传导的缺陷阻碍了病毒清除。然而,包括免疫和非免疫细胞在内的健康细胞,产生IFN元素[例如,Janus激酶(JAK)/信号转导及转录激活因子(STAT)],诱导程序化转录途径,限制病毒复制。因此,OVs不会损害健康细胞(图1)。关于IFN的抗病毒作用存在相当大的争议,因为一些带有IFN途径突变的患者来源的肿瘤/异种移植瘤有时对OV感染表现出相当的抵抗力。识别突变基因并理解它们的作用可能会揭示这一观察结果。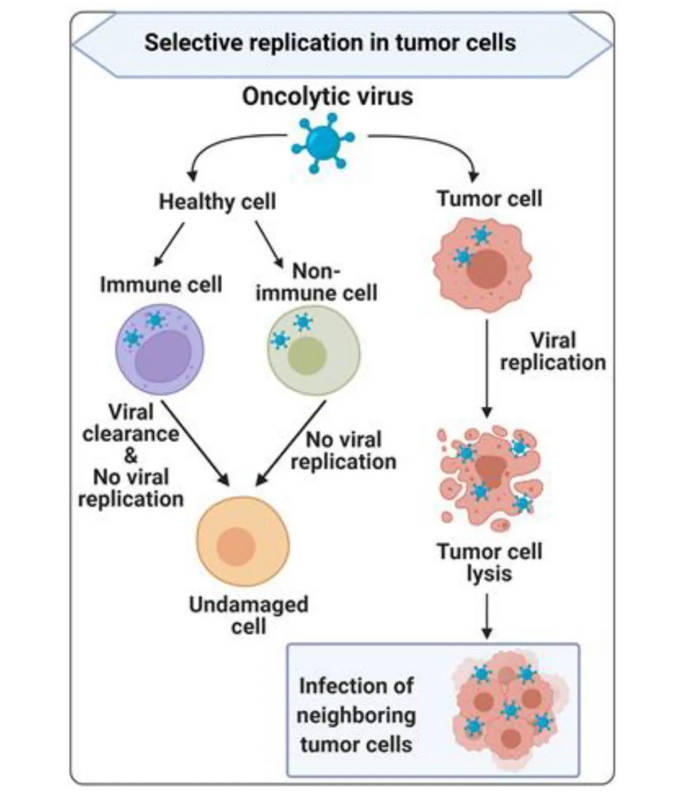
图1. 溶瘤病毒在肿瘤细胞中选择性复制。溶瘤病毒(OVs)可以特异性地感染功能失调的肿瘤细胞并进行复制,直到肿瘤细胞裂解,新生病毒释放出来感染邻近的肿瘤细胞。在健康细胞中,包括免疫细胞和非免疫细胞,由于抗病毒I型干扰素(IFN)信号和其他机制,OVs的复制能力低或无。OVs可以被免疫细胞清除,并且不会损害健康细胞。在肿瘤细胞裂解后,OVs扩散到周围区域,放大溶瘤作用。OV选择性裂解潜力取决于病毒类型、剂量、自然或诱导的病毒趋向性,以及肿瘤细胞对各种形式细胞死亡的敏感性(例如,凋亡、坏死、焦亡和自噬)。然而,过度增强的溶瘤潜力可能会增加正常健康细胞的非靶向和意外毒性风险。此外,病毒编码转基因的表达可能会减弱,因为OV感染的肿瘤细胞将被杀死,导致OV繁殖在一定程度上减少。这种作用导致暂时性减瘤而不是持久反应。病毒复制后,OVs诱导的肿瘤细胞的免疫原性细胞死亡——以释放与危险相关分子模式信号(DAMPs)和肿瘤相关抗原(TAAs)为特征——可以直接消除活性肿瘤,并为系统性免疫反应奠定基础。诱导系统性先天和肿瘤特异性适应性抗肿瘤反应进一步根除肿瘤细胞(图2)。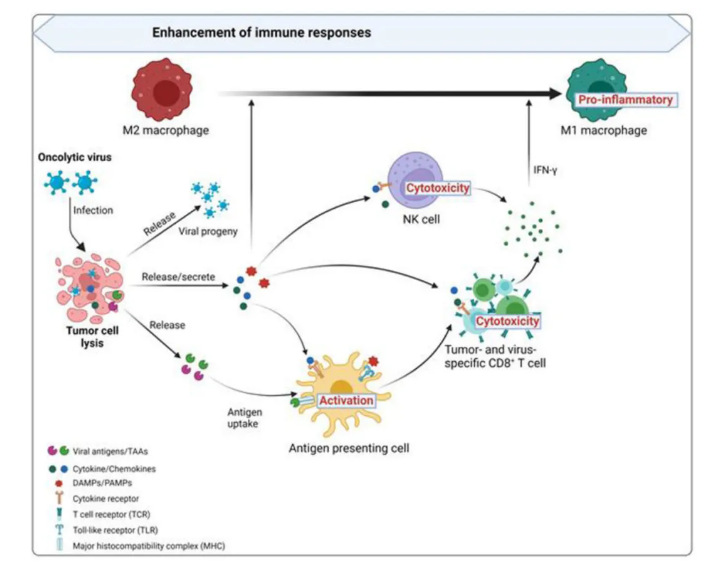
图2. 溶瘤病毒增强免疫反应。感染溶瘤病毒后,肿瘤细胞通过释放抗病毒细胞因子(特别是IFNs)启动抗病毒反应,这些细胞因子促进抗原呈递细胞(APCs)如树突细胞(DCs)的成熟,并且还刺激CD8+ T细胞和NK细胞。在肿瘤细胞裂解后,病毒后代、DAMPs(包括宿主细胞蛋白)、PAMPs(病毒颗粒)和TAAs(肿瘤相关抗原)包括新抗原被释放出来。病毒后代感染更多的肿瘤细胞。DAMPs和PAMPs通过激活包括TLRs在内的受体来刺激免疫系统。TAAs和新抗原被APCs吸收,激活抗原或病毒特异性的CD8+ T细胞反应,从而创造一个免疫刺激性环境。这种变化促使支持肿瘤的M2型巨噬细胞转变为促炎的M1表型。激活先天免疫系统可能既是OVs的障碍也是助手。它减少了病毒持续存在,但需要产生记忆免疫细胞。在溶瘤细胞死亡后,感染的肿瘤细胞释放TAAs,促进适应性免疫反应,以消除未注射或未暴露于病毒的远处肿瘤。此外,它们可以释放细胞因子[如I型IFNs、肿瘤坏死因子-α(TNFα)和白介素-12(IL-12)]、细胞DAMPs和病毒病原体相关分子模式(PAMPs),以促进抗原呈递细胞(APCs)的成熟,从而激活抗原和/或病毒特异性CD8+ T细胞反应。一旦激活,原始CD8+ T细胞变成细胞毒性效应细胞,并转移到肿瘤部位,在那里介导抗肿瘤免疫。I型IFNs和DAMPs直接或间接激活自然杀伤(NK)细胞和巨噬细胞。激活的细胞毒性NK细胞通过释放细胞溶解组分、触发FAS-FAS配体信号传导和表达IFNγ和TNFα来杀死OV感染的肿瘤。这些细胞因子将支持肿瘤的M2型巨噬细胞极化为促炎的M1表型,并招募更多免疫细胞进入TME,呈递抗原给T细胞,这些T细胞反过来产生更多的IFNs和TNFα以放大最初的先天抗肿瘤反应。在识别OV感染后,树突细胞(DCs)也被激活并转变为成熟状态。通过分泌细胞因子和趋化因子,这些DCs诱导NK细胞和巨噬细胞的先天免疫反应。激活的DCs还通过在MHC分子上呈递病毒抗原以及共刺激分子和炎症细胞因子,诱导抗原特异性T细胞,从而诱导适应性免疫,克服肿瘤相关免疫抑制。肿瘤微环境(TME)是一个复杂的癌症和非癌细胞组分发展的生态位,根据促炎细胞因子的产生和免疫细胞浸润水平,可以被描述为免疫学上“冷”或“热”。“冷”TME的特点是炎症免疫细胞少,免疫抑制的TME,预后差,对免疫治疗反应不足。相比之下,“热”TME与激活的免疫细胞的更高反应率相关。OV感染的肿瘤对免疫系统的识别和攻击更为明显。基于OV的免疫治疗通过杀死肿瘤细胞、释放抗原和招募先天效应细胞到肿瘤部位,将免疫原性“冷”肿瘤转化为“热”(图3)。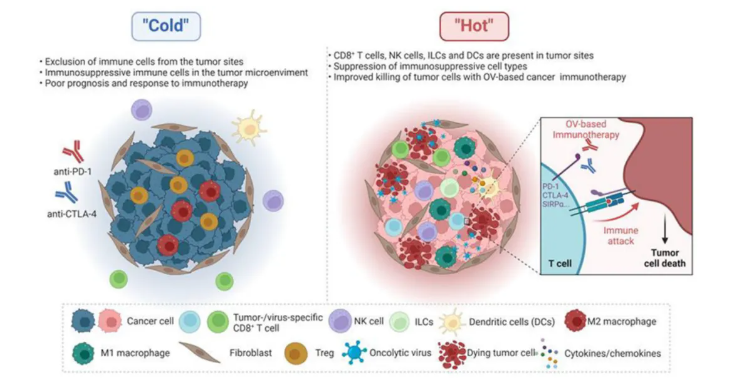
图3. 溶瘤病毒将肿瘤免疫微环境从“冷”改造成“热”。基于OV的癌症免疫治疗可以将肿瘤微环境(TME)进行改造。“冷”TME通常具有高浸润性的免疫抑制细胞,包括肿瘤部位的调节性T细胞(Treg细胞)和M2型巨噬细胞(M2 macrophage),预后较差,对免疫治疗反应不足。相比之下,“热”TME与更高的反应率相关,有更多激活的免疫细胞(例如,CD8+ T细胞、NK细胞、先天淋巴细胞(ILCs)、DCs和M1型巨噬细胞(M1 macrophages))对免疫治疗有反应。OV感染可以增强TME内免疫细胞的浸润和活性,包括先天和适应性免疫细胞。同时,这些治疗性病毒减少了免疫抑制细胞类型的数量,并将免疫细胞转向抗肿瘤表型,从而克服了TME内的免疫抑制。激活的DCs或巨噬细胞可以产生更广泛的肿瘤新抗原特异性T细胞库,其效应功能可以通过免疫检查点阻断(例如,抗PD-1和抗CTLA4抗体)在其杀死肿瘤细胞局部和全身的作用中得到增强。溶瘤病毒治疗激活抗肿瘤免疫通常伴随着各种促炎细胞因子的产生,这进一步有助于生成“热”TME。然而,在极少数情况下,基于OV的免疫治疗也可能产生过多的炎症并导致不良免疫事件,如自身免疫疾病,可能会损害组织或器官。这在十二名接受表达B7.1的VACV治疗的黑色素瘤患者中有两名出现白癜风的例子中得到了体现。结合OVs和免疫检查点阻断剂(ICBs)的治疗已取得令人印象深刻的临床反应。在T-VEC与抗PD-1抗体(pembrolizumab)联合的Ib期临床试验中,转移性黑色素瘤患者的总体和完全反应率分别为62%和33%(表S1,NCT04068181)。不幸的是,随后的随机III期试验(NCT02263508)因临床无效而停止。然而,两项试验使用了不同的治疗方案。在Ib期试验中,T-VEC注射在pembrolizumab之前五周开始,而在III期试验中,两种治疗同时进行。因此,在III期试验中,病毒缺乏时间来加热肿瘤。因此,在OV联合疗法中选择最佳的给药时间点似乎是至关重要的。由于OVs是活病毒颗粒,将它们开发成抗癌药物必须考虑减弱病毒致病性、特异性靶向肿瘤细胞和促进肿瘤细胞死亡。大多数临床相关的OVs使用减毒载体或病毒的天然存在的毒力较低的变体,以防止急性和长期毒性。T-VEC是一种基于减毒HSV-1的病毒。HSV-1因其病毒基因产物ICP34.5而已知会引起神经病毒性和潜伏感染,ICP34.5可防止I型IFN反应并在非分裂细胞内拮抗蛋白激酶R信号通路。由于T-VEC中删除了ICP34.5,病毒无法在神经元内生长或介导潜伏感染。H101是一种E1B缺失的Ad,已在中国获准用于鼻咽肿瘤患者。在一项有160名晚期头颈部或食管鳞状细胞癌患者的随机III期试验中,用顺铂/5-FU和H101治疗的患者有78.8%的反应率,而仅用顺铂/5-FU治疗的患者反应率为39.6%。溶瘤NDV-PV701治疗胶质母细胞瘤(GBM)患者是另一种特定病毒的天然存在的毒力较低的变体的例子。编码外来转基因的能力使OV成为临床开发的有吸引力的载体。腺病毒基因组相对容易修改,可以插入高达10 kb的转基因,而不会破坏病毒的感染能力。HSV基因组为转基因插入提供了大量空间(约25 kb)。因此,许多oAds和oHSVs已被工程化以表达TAAs[例如,人类黑色素瘤相关抗原A3(MAGE-A3)/癌胚抗原(CEA)]、免疫激活分子(例如,CD40L/4-1BBL)和免疫抗抑制分子[例如,针对程序性细胞死亡1(PD-1)/细胞毒性T淋巴细胞相关蛋白4(CTLA-4)/CD47的单链可变片段(scFv)]以对抗各种癌症。我们的团队给oHSVs装备了针对GBM和卵巢癌的全长抗CD47抗体。CD47是一个重要的免疫检查点,与信号调节蛋白α(SIRPα)协作,从而抑制先天免疫细胞的吞噬作用。装备了不同工程版本的抗CD47抗体的oHSVs破坏了CD47和SIRPα之间的相互作用,允许巨噬细胞增强对肿瘤细胞的吞噬作用,并减少肿瘤负担。组合疗法—小鼠OV-αCD47和抗PD-L1小鼠抗体—显著延长了生存期,与相应的单一药物相比,在携带ID8卵巢肿瘤的免疫健全小鼠中。细胞因子是一大类可溶性蛋白、肽或糖蛋白,通过控制增殖、分化、存活和效应功能来调节先天和适应性免疫系统。趋化因子是细胞因子的最大亚家族,可充当免疫细胞的趋化剂。然而,系统性给药超生理剂量的细胞因子/趋化因子通常在临床上是有毒的。相比之下,表达细胞因子或趋化因子的OVs更安全,因为可以通过局部注射控制病毒载量和细胞因子浓度。装备有细胞因子或趋化因子的OVs在临床前研究和临床试验中显示出潜在的抗肿瘤特性。装备有IL-12的oHSV显著增加了TME中的IL-12,并诱导效应T细胞、NK细胞和APCs渗入肿瘤,增强了抗肿瘤效果。oHSV-IL-12作为单药疗法或组合疗法的安全性在临床前得到了证明。正在研究装备有人IL-12的OVs在临床上的应用。IL-23是IL-12细胞因子家族的成员,在癌症免疫中发挥许多作用。装备有IL-23的VACV调节了TME并在动物模型中发挥了强大的抗肿瘤免疫。装备有IL-15的OVs在多种同种异体小鼠肿瘤模型中安全有效。静脉(IV)OV治疗与IL-15和IL-15Rα融合蛋白增强了体内CD8+ T和NK细胞的浸润。我们的团队证明了表达人IL-15/IL-15Rα寿司结构域融合蛋白(OV-IL15C)的oHSV-1促进了GBM中的细胞毒性,并改善了NK和CD8+ T细胞在体外和体内的迁移和存活,并在与嵌合抗原受体(CAR)-NK细胞结合时导致了更好的存活。装备有GM-CSF的OVs已在临床上广泛用于癌症免疫疗法。像T-VEC一样,编码人GM-CSF基因的VACV(JX-594)正在用于治疗晚期肝细胞癌患者。尽管装备有细胞因子的OV有效,但由于细胞因子可以激活免疫细胞来清除病毒,从而限制OV功能,因此它有一个限制。很难平衡抗病毒和抗肿瘤免疫反应。一些细胞因子比其他细胞因子更受关注(例如,GM-CSF和IL-12与IL-23相比)。然而,需要临床数据来确定哪些细胞因子在疗效和安全性方面比其他细胞因子更好。4.4.给OVs装备双特异性/三特异性T细胞引导分子(BiTE/TriTE)双特异性T细胞引导分子(BiTE)是一种由两个scFv组成的重组双特异性蛋白引导分子,它们识别不同的蛋白。一个scFv结合到T细胞上的细胞表面分子,另一个结合到恶性细胞上的抗原。给OVs装备BiTE克服了BiTE分子的一个特定缺点,即它们在血清中的半衰期极短。当并入复制的OV时,BiTE实现了长期肿瘤选择性表达的潜力。异种移植小鼠模型的研究表明,装备有BiTE的OVs通过增加溶瘤作用和激活细胞毒性T细胞诱导免疫介导的肿瘤破坏。针对CD3和肿瘤细胞表面抗原EphA2的溶瘤VACV是第一个测试的BiTE武装OV—在人类肺癌的小鼠异种移植模型中。其他BiTE武装的溶瘤Ad和MV正在开发中。三特异性T细胞引导分子(TriTE),下一代T细胞引导分子构建物,由三个结构域组成(例如,CD3×双肿瘤抗原或肿瘤抗原×CD3/CD28)。双抗原可以减少因抗原丢失而免疫逃逸的倾向,并减少靶向非肿瘤副作用,因为它们提高了肿瘤选择性。自然杀伤组2D(NKG2D),一种强大的激活受体,可以引导NK、CD8+、NKT和γδ T细胞,可能是比传统CD3更好的选择。鉴于肿瘤细胞的特征—抗原异质性—为OV开发选择最佳抗原仍然是一个挑战。选择合适的给药途径对于基于OV的癌症免疫治疗的成功至关重要。将OVs局部注射到单一肿瘤部位,例如瘤内(IT)给药,可以直接针对肿瘤的位置。然而,它对转移性肿瘤的应用有限。全身注射,例如静脉(IV)给药,在清除转移性病变方面在逻辑上更简单、有效,但在达到肿瘤之前,OVs在循环系统中会被迅速清除。包括转化的肿瘤细胞、免疫细胞和干细胞在内的细胞载体,已被用作OVs的全身输送工具。腹腔内(IP)、皮下(SC)、颅内(IC)、肌肉内(IM)、鼻内、膀胱内(IVE)、气溶胶和吸入给药都在临床前和临床上使用(方框2)。在临床前设置中,选择给药方法主要取决于研究项目的目标。在临床环境中,安全性必须优先。
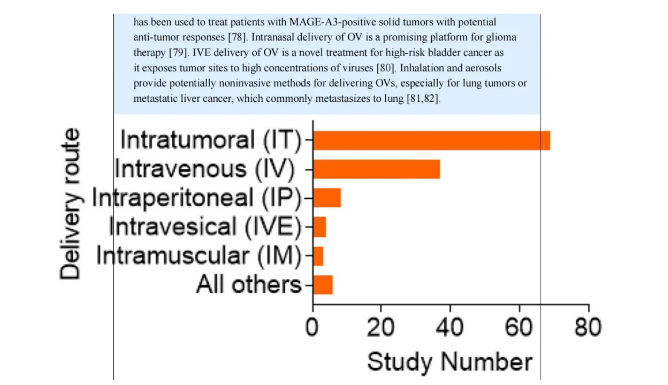
图I. 临床试验中OVs的给药途径。2012年至2022年在ClinicalTrials.gov记录的临床试验中使用的OVs的给药途径。IT(瘤内注射)是最主要的途径(n = 69),其次是IV(静脉注射)(n = 37)。尽管OVs具有抗肿瘤潜力,但在将OVs开发成一类新的抗癌药物方面仍然存在一些独特的障碍,包括OV渗透和扩散不足、宿主的抗病毒免疫、患者选择以及作为单一药物时的低或中等效力。因此,需要更多的实用研究。物理屏障对OVs的渗透和扩散构成了巨大挑战,因为它们需要病毒穿过内皮层才能到达肿瘤部位。细胞外基质(ECM)现在已知通过与肿瘤细胞和TME中的细胞组分相互作用,积极促进肿瘤维持。这种由肿瘤和正常基质细胞分泌的蛋白质和蛋白多糖复合物是OV传播的主要障碍。OVs必须穿过ECM才能进入肿瘤细胞,裂解它们,复制并扩散到周围的肿瘤细胞。因此,调节ECM对于增强OV效力是必要的。例如,表达松弛素(YDC002)的oAd和装备有基质金属蛋白酶(MMP9)的oHSV显著改善了渗透、扩散和持久性,导致异常ECM的选择性降解和有效的肿瘤细胞凋亡诱导。使用病毒融合蛋白修改OVs是另一种方法。结合人CDH1(编码E-钙粘蛋白)的oHSV增加了病毒进入GBM细胞的膜融合,改善了病毒产生,增强了病毒扩散。OV感染的癌细胞处理并呈现其表面的病毒特异性抗原,促进抗病毒免疫细胞如T细胞识别和破坏它们。OV感染的肿瘤细胞引起的免疫学事件(例如,PAMPs和病毒抗原)有助于招募针对肿瘤的效应免疫细胞。增强的抗病毒免疫可能有利于OV诱导的抗肿瘤免疫。然而,OVs可能在到达肿瘤部位之前就被宿主的免疫系统清除。我们的团队证明,NK细胞通过优先裂解oHSV感染的肿瘤细胞,阻碍了GBM病毒治疗。这些NK细胞在病毒感染后2小时内被招募到TME中。它们通过自然细胞毒性受体NKp30和NKp46识别并清除病毒感染的细胞。因此,最初抑制免疫细胞的招募或抑制炎症细胞途径可以抵消免疫细胞清除病毒的倾向。例如,组蛋白去乙酰化酶抑制剂(HDACis)通过抑制STAT5/T-BET信号传导损害NK细胞对oHSV感染的GBM细胞的功能,从而增强溶瘤病毒治疗的抗肿瘤效力。HDACis还通过刺激NF-κB依赖的自噬作用增强了VSV在前列腺癌细胞中的复制和溶瘤作用。在oHSV注射前给予转化生长因子β(TGF-β)抑制了先天免疫反应,并在GBM小鼠模型中改善了抗肿瘤活性。大多数人,包括癌症患者,对HSV都有自然的循环中和抗体,这可能会阻止oHSV的感染和扩散。为了克服这一障碍,在基于OV的免疫治疗中选择适当的OV给药方法是至关重要的。在一项大鼠研究中,预先存在的抗HSV-1抗体显著降低了但并未完全消除HSV-1载体通过基因转移对脑肿瘤的效力。然而,在一个III期试验中,循环中的抗HSV-1抗体未能阻止T-VEC在IT给药后在晚期黑色素瘤患者中的细胞间扩散。将针对人EGFR2(HER2)的oHSV与IL-12和GM-CSF结合,并与抗PD1抗体结合,通过IV注射,减少了HSV-naive和HSV-immune小鼠的肺肿瘤结节形成。然而,不同的肿瘤类型、阶段及其异质性在选择适合OV治疗的患者方面构成了挑战。由于许多临床试验中的患者已经接受了多周期的传统治疗,他们的免疫系统已经被破坏,肿瘤细胞已经发生了根本性的改变。因此,识别可能预测哪些患者适合OV治疗的肿瘤特异性生物标志物至关重要。作为单一药物的OV给药可以减少生物安全问题、复杂性和成本,因为只需要制造和给药一种治疗剂。然而,OVs必须持续足够长的时间以发挥最大的治疗效果,并诱导足够的溶瘤作用以产生持久的适应性抗肿瘤免疫。不幸的是,单一OV给药可能只有低或中等效力,因为宿主的免疫系统可能将其从循环中清除,病毒可能只短暂表达转基因,和/或病毒扩散可能受到限制。病毒颗粒从接受oHSV或oAd治疗的GBM小鼠的大脑中迅速清除(超过80%的清除率在3天内)。在临床上,oAd显示出有限的效力和持久性,特别是在目标组织中。为了延长病毒持久性,多次OV注射和更高的初始剂量可以帮助,但它们可能会引起安全问题。或者,OVs可以被放置在载体细胞内并被运送到肿瘤部位以避免清除。然而,转染效率和载体细胞的裂解是挑战。一个可能的解决方案是将OV与TGF-β或低剂量化疗结合使用,以短暂抑制早期免疫反应,延长病毒持久性并改善OV传递到肿瘤部位。这种方法需要仔细考虑抗病毒反应和抗肿瘤免疫之间的平衡。然而,很可能需要将OV与各种免疫治疗策略安全地结合使用,以提高OV治疗的低或中等效力。OVs不仅本身为癌症治疗提供了一个充满希望的平台,而且与其它癌症治疗结合使用也提供了一个吸引人的机会。这是因为,如上所述,作为单一药物的OV的效力尚未优化以达到最大的抗肿瘤效果。因此,OV治疗现在被认为是免疫疗法的强大伙伴。本节主要关注OVs与其他癌症治疗形式的组合(图4)。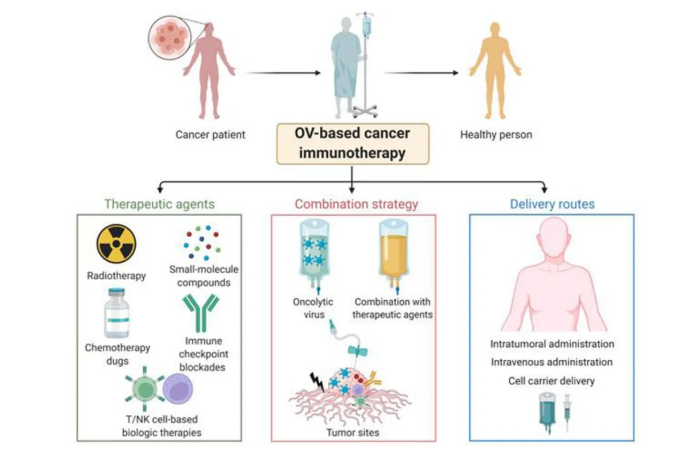
图4. 溶瘤病毒作为癌症组合疗法的基础。传统的治疗策略,如放疗、化疗药物、小分子化合物,以及最近的免疫检查点阻断和基于细胞的免疫疗法(CAR T/NK细胞疗法)已用于治疗癌症。OVs提供了一个基础,并与这些传统疗法和生物疗法结合时,成为一个充满希望的治疗平台。用于输送溶瘤病毒的给药途径通常包括瘤内注射、静脉注射和细胞载体。OVs可以用作放射增敏剂。NIS(Na+/I−共转运蛋白)是一种内在的质膜蛋白,促进细胞摄取放射性核素(例如,131I)。与放射性核素治疗结合使用时,装备有NIS的溶瘤VSV显示出高瘤内病毒复制,导致皮下或正交小鼠肿瘤模型中的肿瘤消退增强和生存期延长。最近,oAd DNX-2401加放疗为新诊断的DIPG患者提供了组合免疫治疗的合理性。在12名接受单一瘤内注射DNX-2401病毒颗粒的胶质瘤患者中,有11名患者接受了随后的放疗,中位剂量为54 Gy。12名患者中有9名患者的T细胞活性增强,肿瘤大小减少或稳定。将化疗与OVs结合使用为癌症免疫治疗提供了另一种选择,因为化疗可以通过使OVs规避抗病毒免疫反应来增强溶瘤病毒治疗。环磷酰胺(CPA),一种用作免疫抑制药物的化疗烷化剂,与溶瘤病毒治疗结合使用,诱导肿瘤细胞凋亡性细胞死亡,并影响先天和适应性免疫反应的体液和细胞介导因子。CPA已显示出全局免疫抑制功能,从而增强病毒溶瘤作用并改善HSV、Ad、MV、reovirus和VACV的抗肿瘤效力。CPA加上装备有GM-CSF的oAd通过抑制调节性T细胞并诱导T辅助细胞类型1免疫来增强抗肿瘤免疫,以对抗免疫抑制的TME。此外,OVs可以用作化疗的佐剂,特别是在耐药肿瘤的情况下。尽管化疗可以通过防止由于抗病毒免疫而消除OV来增强OV治疗,但它也可能减少OV的治疗效力。例如,低剂量CPA去除了免疫抑制细胞(例如,Treg细胞)以改善疫苗诱导的适应性抗肿瘤免疫反应,同时促进抗病毒免疫反应以早期清除病毒。然而,高剂量CPA通过广泛抑制先天和适应性抗病毒免疫反应来增强病毒溶瘤能力,但也完全取消了抗肿瘤免疫反应。替莫唑胺,GBM的当前护理标准,对oHSV免疫病毒治疗产生了不利影响。这些结果表明,化疗和OV治疗的临床组合应仔细考虑。多种小分子化合物被用来抑制抗病毒信号通路,它们有潜力增强OV复制甚至解决肿瘤细胞中的OV抗性。FDA批准的药物鲁索利替尼,一种特定的JAK-1/2抑制剂,通过对抗抗病毒JAK/STAT信号传导增强了多种OVs的活性,在各种临床前研究中未观察到毒性。干扰素基因(STING)信号通路的刺激器是抗病毒感染的关键天然免疫通路,导致肿瘤免疫逃逸。因此,当溶瘤病毒治疗结合特定的STING抑制剂时,可能会从STING缺陷或功能障碍中受益。免疫检查点是免疫系统的调节器,对自身耐受至关重要,可以防止免疫系统不加选择地攻击细胞。然而,一些癌症可以通过刺激免疫检查点靶标来保护自己免受攻击。ICB治疗通过针对检查点受体[例如,PD-1、CTLA-4、淋巴细胞激活基因-3(LAG-3)和T细胞免疫球蛋白和ITIM结构域(TIGIT)]或配体(例如,PD-L1)来中断免疫抑制肿瘤信号并使抗肿瘤免疫反应正常化。尽管将OVs和ICB结合使用可能会导致病毒更强烈的清除,但它可以实现更具免疫原性的TME并增强抗肿瘤效力。多个正在进行的临床试验正在结合OVs和ICBs,但PD-1/PD-L1和CTLA-4加OV组合疗法进展最为显著。T-VEC与抗PD-1抗体(pembrolizumab)结合在II B期和IV期黑色素瘤患者的Ib期试验中产生了令人鼓舞的抗肿瘤结果。它改变了TME,增加了细胞毒性CD8+ T细胞渗入肿瘤部位,并提高了IFNγ水平。尽管由于临床无效性在III期试验中被停止,但如果可以确定最佳治疗时间点,这种组合疗法可能需要进一步的临床测试。另一项Ib期试验(NCT01740297),结合了T-VEC与抗CTLA-4抗体(ipilimumab),在IIIB-IV期黑色素瘤患者中显示出增强的抗肿瘤效力,并产生了可接受的安全性概况。在随后的II期研究中,这种组合疗法获得了明显更高的客观反应率(39%),与单独使用ipilimumab(18%)相比。过继T细胞转移(ACT)治疗显著促进了癌症治疗。与OVs结合使用,特别是对于实体瘤治疗,ACT治疗受益于延长的T细胞持久性和由装备有细胞因子或趋化因子的OVs介导的更大的抗肿瘤反应。瘤内注射装备有hGM-CSF的oAd,并与体外激活的卵清蛋白特异性CD8+ T细胞(OT-I)结合,增加了内源性CD8+ T细胞的数量,导致B16.F10肿瘤再挑战的排斥。装备有CXCL9-11或CCL5的OVs也增加了TME中的T细胞浸润和持久性。TAA工程化的OVs作为疫苗刺激T细胞,产生最大的抗原靶向反应。此外,用OVs预处理建立的肿瘤可以将TME从免疫学上的“冷”重新编程为“热”,改善T细胞的招募和效应功能。肿瘤浸润性淋巴细胞(TILs)可以轻易地在体外扩增(细胞数量高达1011),并选择识别肿瘤。OVs和具有效应功能的TILs的结合正在卵巢和胰腺癌小鼠模型中研究以增强抗肿瘤活性。仔细选择CAR靶标可以实现更好的肿瘤选择性并减少CAR靶标,已在多个小鼠癌症模型中显示出有希望的结果。Park等人设计了一种溶瘤VACV,将自然发生的抗原CD19传递给肿瘤细胞,然后可以用CD19特异性CAR-T细胞靶向。死亡的肿瘤细胞释放了额外的病毒副本,将CD19表达传播到相邻的肿瘤细胞,从而诱导更有效的抗肿瘤反应。溶瘤VSV或reovirus与双特异性CAR-T细胞结合在皮下黑色素瘤和小鼠胶质瘤模型中增强了CAR-T细胞的效力。OVs刺激具有特定病毒T细胞受体的记忆CAR-T细胞,从而增强T细胞增殖和CAR导向的抗肿瘤功能。然而,CAR-T细胞治疗产生了某些严重的不良事件,如细胞因子释放综合征(CRS)。因此,在使用CAR-T细胞作为单一疗法或与溶瘤病毒治疗结合使用时需要考虑安全性概况。NK细胞是先天免疫系统的关键组成部分。与T细胞相比,NK细胞为肿瘤免疫治疗提供了多方面的优势。它们不需要人类白细胞抗原(HLA)匹配,并且不产生移植物抗宿主病(GvHD)。此外,与迄今为止一直是自体或HLA匹配的过继T细胞治疗不同,可以使用同一批不匹配的、异体的NK细胞来治疗不同患者的相同类型的癌症。NK细胞的“现成”特性使它们更适合商业开发。我们成功地使用脐带血(UCB)衍生表达PD-L1并分泌IL-15的NK细胞(COH06)。我们证明了COH06杀死了更多有或没有PD-L1抑制剂(atezolizumab)的肿瘤细胞,并且分泌的IL-15允许NK细胞活得更久。我们的团队正在使用这些工程化的NK细胞治疗非小细胞肺癌患者的I期试验(NCT05334329)。为了增强NK细胞的抗肿瘤效果,OVs可以被修改以表达NK细胞刺激细胞因子,如IL-12、IL-15和IL-18。这种修改的OVs与NK细胞结合在NK细胞依赖的方式中显著抑制了肿瘤细胞的生长,因为OVs在TME中释放了强大的细胞因子。然而,将趋化因子与匹配的受体结合可以改善NK细胞归巢和治疗效果。事实上,与CCL5修饰的溶瘤VACV与CCR5过表达的NK细胞的结合比相应的单一药物在结肠癌模型中更有效。与CAR-T细胞治疗一样,NK细胞可以被工程化以表达CARs,以便它们特异性地靶向肿瘤细胞。CAR-NK细胞——可以从UCB、诱导多能干细胞(iPSCs)、外周血单核细胞(PBMCs)或NK-92等NK细胞系衍生——可以作为“现成”产品制造和储存。在11名复发或难治性CD19阳性癌症患者的I-II期试验(NCT03056339)中,UCB衍生的CAR-NK细胞扩增并持续了>12个月,没有神经毒性、CRS或GvHD。在乳腺癌转移性中枢神经系统肿瘤模型中,瘤内注射oHSV与靶向EGFR的CAR-NK-92细胞结合改善了抗肿瘤效果并延长了存活。我们在同种异体GBM小鼠模型中证明了当OV-IL15C与来自PBMCs的“现成”EGFR-CAR-NK细胞结合时,产生了协同的抗肿瘤效果。在这里,我们回顾了OVs作为单一药物或与其他策略结合使用在癌症免疫治疗中的介导作用。当OVs与ICBs、化疗药物或其他策略结合使用时,实验模型中的生存结果通常会改善。在临床阶段,OVs越来越被认为是对抗各种晚期肿瘤的有前途的治疗工具,迄今为止,组合疗法尚未产生额外的可观察毒性。对免疫系统和病毒病原体和肿瘤细胞之间的分子相互作用的增加理解将帮助我们设计更好的抗肿瘤OVs。此外,选择最适合特定免疫治疗作用的OV载体也很重要。例如,像HSV、Ad和VACV这样的病毒复制较慢,因此可以维持转基因生产,可以可靠地将免疫调节剂输送到TME中,将“冷”免疫抑制性TME转变为“热”炎症性TME。需要额外的研究来最小化抗病毒活性但最大化抗肿瘤活性,随着OV的发展(见未解决问题)。这反过来应该有助于设计更有效和更安全的组合疗法。总之,基于OV的病毒治疗是一种新兴的癌症免疫治疗形式。其成功的挑战包括但不限于OV持久性不足、TME中有限的病毒复制和扩散、作为单一疗法的低疗效和系统治疗的安全性概况。因此,更好地了解OVs、免疫细胞、肿瘤细胞和TME其他组分之间的相互作用可能有助于开发更具创新性的OVs,并最终在患者中实现更好的临床结果。













