用于T细胞工程慢病毒载体:临床应用、生物加工及未来展望
摘要:慢病毒载体在基因修饰细胞疗法的兴起中发挥了关键作用,特别是T细胞疗法。Tisagenlecleucel(Kymriah)、Axicabtagene ciloleucel(Yescarta)以及最近上市的Bexucabtagene autoleucel(Tecartus)是现在商业化分发的T细胞疗法的例子,它们在成功获得EMA和FDA批准用于治疗血液癌症后,已经上市。这三种疗法都依赖于逆转录病毒载体将治疗性嵌合抗原受体(CAR)转导到T淋巴细胞中。尽管这些创新代表了充满希望的新治疗途径,但在使它们成为医疗护理中随时可用的工具方面仍存在重大障碍。本文回顾了慢病毒(LV)载体和T细胞治疗的生物学原理以及生物加工。还讨论了临床和工程的成功、不足和未来的机会。开发符合良好生产规范(GMP)的仪器、技术和协议将在LV工程化T细胞疗法的发展中发挥重要作用。

1.引言
病毒是由蛋白质外壳保护的核酸组成的传染性生物。这些微生物不能自我复制,而是依赖于它们感染的细胞,通过劫持宿主的复制机制来产生更多自己的副本。病毒通常与疾病相关,但遗传工程师重新利用了它们的生物学特性,利用它们自然的能力来修改或补充宿主细胞的遗传密码,生产出一类称为病毒载体的新的基因传递工具。伽马逆转录病毒(GRV)和慢病毒(LV)载体来源于逆转录病毒科的包膜RNA病毒,由于它们能够将遗传物质整合到宿主细胞基因组中并稳定表达外源基因,因此它们在研究和临床中得到了广泛应用,特别适合转导高度复制的细胞,如免疫细胞。嵌合抗原受体(CAR)T细胞疗法是迄今为止最成功的免疫疗法类型,也是唯一上市的基于T细胞的疗法。为了生产CAR T细胞,T淋巴细胞被遗传修饰以表达CAR受体,赋予它们识别和摧毁癌细胞的能力。CAR T细胞疗法在治疗血液癌症方面显示出了有希望的结果,特别是CD19阳性B细胞恶性肿瘤,三种产品Tisagenlecleucel(Kymriah)、Axicabtagene ciloleucel(Yescarta)和最近上市的Bexucabtagene Autoleucel(Tecartus)获得了市场授权。这些疗法的载体和细胞元素的生物加工很少同时考虑,也不一定由同一制造商生产。生物技术和制药行业越来越多地参与T细胞工程疗法和赞助临床测试,证明了这一治疗领域的快速发展。在这篇综述中,我们将介绍用于基因修饰T细胞疗法的LV载体的基本生物学原理和生物加工,以及最近的临床和工程进展。
2.慢病毒载体
2.1.生物学原理
逆转录病毒载体的两个主要类别是GRV和LV载体。两者之间的主要区别在于GRV载体只能感染分裂的细胞,而LV载体也可以感染静止的细胞。慢病毒载体已经在多种临床前应用中用于治疗遗传性疾病,如B型血友病和黄斑变性,通过体内传递。慢病毒载体也用于体外转导细胞以用于治疗应用,最先进的临床应用是CAR T细胞疗法。本综述将重点讨论LV载体在T细胞疗法开发和制造中的使用和应用。慢病毒载体来源于逆转录病毒科的病毒,最常见的是人类免疫缺陷病毒1型(HIV-1),并已用于研究和治疗应用。还开发了使用不同来源病毒的变体LV,如猴免疫缺陷病毒(SIV)、猫免疫缺陷病毒(FIV)或马传染性贫血病毒(EIAV)。LV是通过依赖逆转录病毒将其遗传物质整合到宿主细胞基因组中的自然能力,有效修饰真核细胞的手段。LV可以被修改以携带高达10 kb的基因,并稳定转导感兴趣的基因,通常被称为“表达盒”。LV基因组编码三个结构基因,在野生型病毒和工程载体中发挥相同功能。这三个基因是群特异性抗原(gag)、聚合酶(pol)和包膜(env)。gag基因编码病毒的结构蛋白,包括基质蛋白、衣壳蛋白和核衣壳蛋白。这些蛋白是蛋白质骨架的一部分,作为病毒RNA基因组的保护层。pol序列编码病毒复制周期所必需的酶功能。这包括蛋白酶,它将HIV未成熟蛋白切割成成熟的功能性蛋白;逆转录酶(RT),将病毒基因组单链RNA(ssRNA)逆转录成双链DNA(dsDNA);整合酶,它切割宿主基因组DNA以整合病毒dsDNA。env序列编码包膜蛋白,负责HIV细胞进入和通过与目标受体的相互作用来确定嗜性。包膜蛋白复合体是由env编码的两种蛋白gp120和gp41形成的异二聚体。Gp120和gp41通过从包膜膜突出的域与它们的靶标受体CD4、CCR5和CXCR4相互作用。此外,HIV基因组编码调节元件Tat和Rev和辅助蛋白Nef、Vpr、Vif和Vpu。虽然调节元件对HIV复制是必需的,但辅助蛋白增强病毒复制,并与体内的致病性相关。最后,HIV基因组编码参与如核输出、包装和基因表达等功能的基本序列。Rev-Response Element(RRE)与Rev相互作用,允许在病毒复制期间未剪接和单剪接HIV RNA的核输出。HIV DNA基因组由两个在病毒RNA逆转录过程中产生的长末端重复(LTR)序列所包围,对病毒基因组整合到宿主细胞DNA和病毒基因组表达至关重要。LV是通过将逆转录病毒基因组的组件组合成重组质粒DNA(pDNA)而开发的。然后可以将pDNA转染到生产细胞系中。为了增加可以包装到载体中的遗传有效载荷,抑制复制,并限制致病性,同时保留功能,对LV基因组进行了修改。第一代LV与野生型病毒基因组最为相似。为了限制创建复制能力慢病毒(RCLs)的风险,病毒基因被装载到三个单独的质粒上。该系统由包含结构gag基因和调节蛋白的包装质粒组成——包含gp160或其他替代病毒包膜的糖蛋白的包膜质粒,以修改嗜性(例如,VSV-G)——以及包含两个HIV LTRs的转移质粒。包装和env质粒不包含LTR序列和ψ包装序列,而是被巨细胞病毒(CMV)启动子所取代,以进一步防止RCLs的形成。第二代LV生产系统从包装质粒中去除了辅助蛋白Nef、Vpr、Vif和Vpu,因为这些与疾病进展、致病性和通过人类社区的传播相关,但对病毒功能如逆转录、整合或成熟不是必需的。第三代也是最新的LV生产系统修改了转移质粒的5' HIV LTR序列,并用强大的病毒启动子(如CMV或Rous肉瘤病毒(RSV)启动子)替换,允许从系统中去除tat,并进一步防止RCLs的形成。最后,Rev元素从包装质粒中移除,并装载到一个新的调节质粒上,形成了一个四质粒系统,增加了对RCL形成的安全性。所有三代LV载体及其相应的质粒系统已在图1中总结。
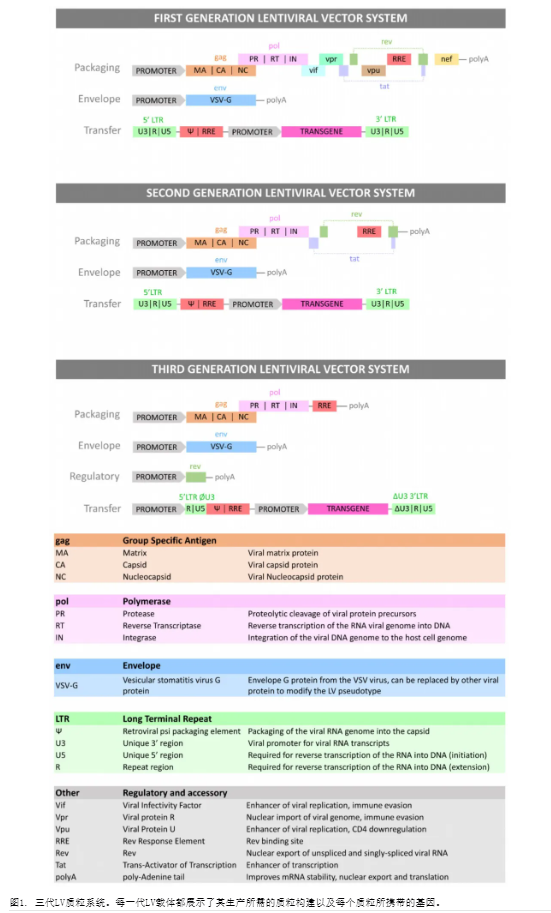
2.2.LV生物加工
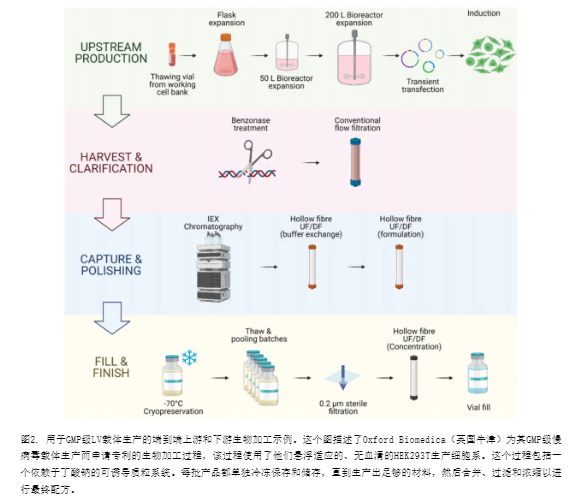
LV载体生物加工可以分为两个主要阶段,即上游加工(USP)和下游加工(DSP)。病毒载体的USP指的是病毒颗粒产生的步骤。这是通过将DNA转移到包装细胞中实现的,这些细胞被用作载体工厂。在工艺开发阶段,这通常是在2D细胞培养中完成的,并扩大到生物反应器生产,用于临床和商业生产。所使用的细胞是永生化细胞系,最受欢迎的是人胚肾细胞系HEK293T。HEK293T是一种贴壁细胞系,这在扩大规模时涉及挑战,因为大多数大规模生物反应器都适用于悬浮细胞培养。一些替代方案,如固定床生物反应器,已被提出作为有效扩大规模的解决方案。或者,为了解决这个问题,也尝试开发HEK293T细胞的悬浮变体。病毒载体生物加工从扩增生产细胞系开始,例如HEK293T细胞。然后,细胞被质粒DNA(pDNA)转染以转移LV颗粒生产所需的基因。随着它们的成熟,LV载体从生产细胞膜上出芽并释放到细胞培养基中。因此,与腺相关病毒(AAV)载体等其他非包膜载体不同,不需要细胞裂解步骤来释放颗粒。生产出的载体的DSP在收获生产细胞培养上清后开始。这种产品高度异质,包含大量的工艺和产品相关杂质。澄清步骤是为了去除聚集体和细胞碎片等大杂质,可以通过过滤或离心实现。为了在后期去除污染的核酸,这一步可能包括核酸酶消化。捕获步骤旨在保留和浓缩LV颗粒,并进一步去除工艺和产品相关杂质。可能添加中间纯化步骤以交换LV缓冲液、浓缩产品或去除特定杂质。然后是抛光步骤,以去除剩余的杂质,这些杂质通常由于与LV载体的物理性质相似而最难从最终产品中分离。捕获和抛光步骤可以通过多种下游加工技术的组合来实现,可能包括超离心、超滤/透析(UF/DF)、切向流过滤(TFF)、液相色谱或无菌过滤。最后一步或填充完成步骤包括LV载体的最终配方,可能包括缓冲液交换、无菌过滤、冷冻保存或添加辅料。大规模LV生物加工的一个例子在图2中展示。
3.基因修饰T细胞疗法
3.1.生物学原理
T淋巴细胞在免疫中的一个作用是检测和摧毁被有害病原体感染的细胞。在感染期间,T细胞可以在呈递特定传染病原的免疫原部分,称为抗原时,检测到外来病原体。这种激活是通过T细胞受体(TCR)介导的,由CD3受体和CD4或CD8共受体组成。CD4共受体由辅助T细胞在与抗原呈递细胞相互作用时使用,以激活它们的细胞因子释放功能,这促进了其他免疫细胞的招募和激活,而CD8共受体由细胞毒性T细胞用来激活它们的细胞杀伤功能。其他共受体,包括OX40、CD28和4-1BB,增强了细胞功能,如增殖、细胞因子产生和细胞存活。一旦激活,T细胞将开始快速分裂,产生促炎因子并激活其细胞毒性功能以摧毁感染细胞。当感染解决后,由克隆扩展产生的激活T细胞群将变得筋疲力尽、衰老,并最终经历凋亡。这个过程只留下一小部分持久的记忆细胞,能够检测到相同的抗原并经历快速的克隆扩展,随后分化以产生强大和特定的适应性免疫反应。
在胸腺中的成熟过程中,识别自身肽段的T细胞被移除,以防止自身免疫反应。癌症细胞中存在的遗传和表观遗传修饰导致细胞功能如代谢、增殖、DNA修复、凋亡、运动和附着的失调。免疫系统有能力检测到这些因素中的一些,并利用其杀伤功能来根除癌细胞。肿瘤微环境(TME)的修饰也可以是免疫系统的潜在靶标,因为TME的特征与健康周围组织明显不同。被吸引到TME并渗入肿瘤的淋巴细胞被称为肿瘤浸润淋巴细胞(TIL)。这些免疫细胞的存在与癌症患者的更好预后和缓解机会相关,它们已在临床上用于自体细胞治疗。然而,癌细胞源自受损或突变的健康细胞,因此对免疫系统来说可能很难检测。
嵌合抗原受体或CAR是一种能够结合目标抗原的工程TCR。CAR可以被引入T淋巴细胞中,以产生具有检测特定抗原能力的CAR T细胞。CAR由人类IgG抗体的单链可变片段(scFv)组成。已经开发了三代CAR:第一代是与CD3信号结合的scFv片段,以促进CAR T细胞的细胞毒性活性。第二代还包含一个CD28信号,以促进目标结合后的细胞增殖和细胞因子产生。第三代CAR增加了4-1BB和OX40区域,以促进细胞存活并延长CAR T细胞体内的持久性。最近开发了第四代,并包含特定的细胞因子信号,使CAR T细胞对TME的免疫抑制效应产生抗性,并进一步提高它们体内的寿命。
3.2.T细胞疗法生物加工
两种主要的方法已经从T细胞过继疗法中出现,依赖于两种不同的来源材料。异体方法依赖于来自“通用”来源的细胞,采取一种一刀切的策略。自体方法依赖于直接从患者体内获取的细胞,用于个性化医疗类型的治疗。所有商业上可用的T细胞过继疗法都依赖于自体原则,因为异体方法由于HLA分型和干细胞技术的早期发展而被证明难以开发。
对于大多数商业上可用或在临床开发中的CAR T细胞疗法来说,细胞是通过白细胞分离术或白细胞分离术从患者的外周血单个核细胞(PBMCs)中分离出来的。这种材料包含大量免疫细胞,包括B细胞、巨噬细胞、单核细胞、NK细胞和T细胞。第一个制造步骤是从PBMCs中分离出T细胞亚群,这可以通过磁性珠选择或选择性扩增来完成。磁性选择是指将磁性珠与抗体结合,这些抗体与目标T细胞群体结合,当通过磁性柱时可以分离出来。对于CAR T细胞的开发,可以使用抗CD3或抗CD4和抗CD8抗体的组合来选择T淋巴细胞。选择后,细胞通常在培养基中休息数小时。然后可以使用含有CAR盒的病毒载体转导细胞。这一步允许将CAR基因引入细胞,以产生完全功能的CAR T细胞。病毒转导的替代方法是转染。T细胞可以通过化学转染,使用聚乙烯亚胺(PEI)等转染化学试剂,或通过电穿孔,使用电流在细胞膜上形成孔隙,使pDNA进入细胞来进行转染。这些方法需要大量的pDNA,因为它们是在扩增阶段的末端进行的,涉及更多的细胞数量,因此在治疗应用中使用有限。
在生产用于治疗应用的CAR T细胞时,可以通过四种主要类型的遗传物质转移来实现基因传递:将基因稳定整合到宿主T细胞基因组DNA中;非整合的瞬时转移,转基因DNA作为环状体存在;病毒载体介导的转导;和非病毒转导。为了达到治疗患者所需的细胞治疗剂量,细胞在培养中被保留并允许扩增。为了刺激T细胞扩增,使用与单克隆抗体结合的珠子激活细胞,这些抗体针对CD3和CD28 T细胞受体。激活后的细胞可以在生物反应器中培养,这提供了在封闭系统中扩增细胞的可能性,中等规模,并在整个过程中进行采样和监测,以控制产品质量。
CAR T细胞疗法的开发面临一些挑战,包括细胞扩增不良、体内寿命短以及治疗患者的重大副作用。获得足够的目标T细胞以提供功能性治疗是主要挑战之一。用于临床前药物开发的材料通常来自健康捐赠者,而临床使用的材料来自接受过包括化疗、放疗、免疫疗法或所有这些组合的严酷治疗方案的晚期癌症患者。因此,临床使用的材料质量较差,变异性较高。最后,从处于危急状态的患者中采样免疫细胞将对他们的健康和生存机会产生重大影响。因此,有效的细胞扩增技术对于将CAR T细胞疗法从“实验室到床边”至关重要。
尽管取得了很大成功,但CAR T细胞疗法已被证明存在重大安全挑战。这是因为CAR T细胞可能触发称为细胞因子释放综合征(CRS)或“细胞因子风暴”的免疫反应级联反应。CRS是由T细胞的组成性过度激活引起的,导致大量促炎因子的释放,激活更多免疫细胞进入正反馈循环。CRS症状包括高烧、癫痫发作、器官衰竭、低血压和全身性炎症反应,可能导致死亡。
4.LV载体技术在T细胞工程中的应用
4.1.引言
LV载体是体外研究和开发的成熟技术,最近它们在临床应用中越来越受欢迎。事实上,LV临床应用的安全性和有效性已经为许多临床试验所证明,一些产品已经获得市场授权。图3描述了生产商业上可用的自体疗法所用的制造过程。然而,需要解决CRS、神经毒性和总体成本等挑战,以使T细胞过继疗法成为一种广泛可及的治疗。开发符合良好生产规范(GMP)的仪器、技术和技术对于LV工程化T细胞疗法的开发至关重要。在本节中,我们将介绍LV载体技术在T细胞工程中的一些应用。以下讨论了目前可用的CAR T细胞疗法、旨在将LV应用整合到T细胞工程中的技术、基于LV的T细胞疗法开发研究和开发工具、使用LV修饰的供体T细胞的异体方法以及CAR T细胞疗法的替代品。
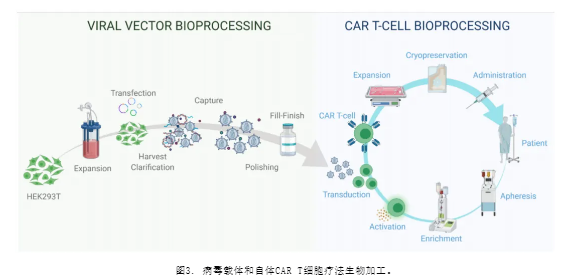
病毒载体生物加工始于生产细胞系的扩增,例如HEK293T细胞。然后,细胞通过质粒DNA (pDNA) 载体进行转染。转染后,从细胞上清中收获产生的病毒颗粒。澄清步骤是为了去除大的杂质,如聚集体和细胞碎片;这一步骤可能包括核酸酶消化步骤。捕获步骤旨在保留慢病毒(LV)颗粒并进一步去除杂质。抛光步骤去除与LV载体物理性质相似的杂质。填充-完成步骤包括LV载体的最终配方。
自体CAR T细胞生物加工从通过白细胞分离术或白细胞分离术从患者中分离外周血单个核细胞(PBMCs)开始。为了从PBMCs中分离T淋巴细胞,可以引入使用抗体偶联磁性珠的富集步骤。使用抗CD3/CD28抗体偶联珠激活T细胞。激活后,使用慢病毒载体转导细胞,CAR治疗基因整合到目标T细胞基因组中,以产生完全功能的CAR T细胞。然后,在培养中扩增激活的T细胞,以达到治疗输注所需的细胞数量。然后收获细胞材料,并在-120°C下进行冷冻保存。然后将材料运回诊所,通过静脉输注给患者。
4.2.商业上可用的基因修饰T细胞疗法
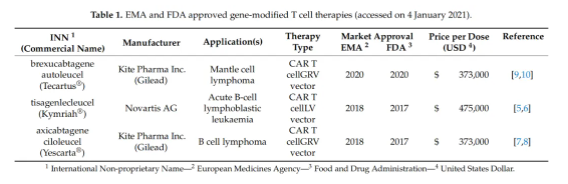
在获得市场授权的三种CAR T细胞疗法中,brexucabtagene autoleucel (Tecartus, Kite Pharma Inc., Los Angeles, CA, USA) 和 axicabtagene ciloleucel (Yescarta, Kite Pharma Inc.) 都使用GRV载体进行转导,而 tisagenlecleucel (Kymriah®, Novartis International AG, Basel Switzerland) 使用慢病毒载体进行转导。Brexucabtagene autoleucel 和 axicabtagene ciloleucel 都使用相同的病毒载体在MSCV启动子的控制下转导转基因有效载荷。Tisagenlecleucel 使用独特的LV载体,并且转基因在EF-1a启动子的控制下。尽管目前正在对其他采用T细胞疗法的基因转移技术进行临床评估,但还没有获得市场授权,这表明逆转录病毒载体作为细胞治疗应用的基因转移工具的重要性。所有EMA和FDA批准的疗法已在表1中列出。当前的自体CAR T细胞疗法协议已建立,并在图3中展示。这种自体方法代表了商业产品的可行选择,但需要进一步改进以满足全球需求。由于成本和生产能力,目前商业上可用的LV工程化T细胞疗法仅被视为对常规化疗、放疗和免疫治疗无反应或复发的患者第二、第三或第四线治疗选择。必须同时考虑改进生产LV载体和T细胞工程所需的生物工艺和技术,以改善患者获取。为解决流程瓶颈、增强功能性和提高LV工程化T细胞疗法的安全性,已提出最近进展。
细胞和基因治疗所涉及的物流包括患者材料的采购、生产、运输、调理和药品的储存,被视为使细胞和基因治疗成为一种可行治疗解决方案的主要瓶颈之一。目前在美国进行的22天生物工艺对包括欧盟在内的其他市场构成了重大挑战,因为在收到治疗之前,患者需要两次跨越大西洋运输他们的细胞,这突显了当前自体T细胞疗法方法所面临的物流问题。为缓解这一问题,诺华公司正在增加在法国和瑞士的生产能力。
欧洲药品管理局(EMA)优先药品计划(PRIME)和美国联邦食品药品监督管理局(FDA)突破性疗法认定已开发出来,以促进在临床前研究中显示出对当前护理标准有显著改进的药品的市场批准。这三种疗法都从这种加速评估中受益,因为这些疗法对B细胞恶性肿瘤显示出高疗效,并满足了未满足的临床需求。
Tisagenlecleucel在2018年获得了FDA和EMA的批准,用于治疗套细胞淋巴瘤(MCL)。T淋巴细胞通过慢病毒载体进行修饰,以转导抗CD19 CAR,然后修饰后的细胞再输回患者体内。第二阶段的临床研究仍在进行中(ELIANA, NCT02435849),结果已公布,并计划在2022年11月完成。第三阶段(BELINDA, NCT03570892)目前正在进行,但由于成功的加速批准状态,tisagenlecleucel可以在完成之前商业化。来自抗CD19 CAR T细胞方法的令人鼓舞的结果导致增加了努力以标准化实验开发协议并预测临床要求。
4.3.限制、安全性和有效性
尽管CAR T细胞疗法在治疗血液癌症方面取得了初步的临床成功,但安全性问题和提高实体肿瘤的疗效仍然是需要解决的障碍。除了将慢病毒基因分离到单独的质粒DNA构建中以避免RCL生成外,还对慢病毒载体进行了几项修改以提高安全性。一种减轻CAR T细胞输注后不良反应发展的解决方案是包含含有“自杀基因”的转基因。“自杀基因”允许通过添加一种特定化学试剂来选择性杀死CAR T细胞,这种试剂对未修饰的细胞本身无毒。这项技术已进展到临床前和临床阶段。例如,针对多发性骨髓瘤(MM)的抗SLAMF7疗法包含了一个二聚化结构域与caspase-9结构域自杀基因的融合,以减轻非靶向激活的风险,因为SLAMF7在包括NK细胞在内的健康白细胞上表达。作者已在体外和体内显示出疗效,并且通过添加二聚化剂AP1903 (利米杜西)可以消除修饰的细胞。
CAR T细胞制造的另一个相关风险是其他细胞类型与转基因的转导。单个白血病B细胞的转导导致了接受抗CD19 CAR T细胞疗法tisagenlecleucel (Kymriah)治疗的患者中耐药转基因克隆的发展。这导致了在制造过程中由于CAR治疗基因的顺式整合而掩盖了目标CD19表位。尽管这是一个罕见的事件(当时治疗的369名患者中有1名),但使用具有广泛嗜性的整合载体可能代表一个严重的安全问题。用于这种疗法的载体使用了VSV-G包膜蛋白进行假型化,这赋予了载体广泛的嗜性。建议工程化更具体的嵌合包膜蛋白作为一种解决这个问题的方法。基于麻疹包膜的嵌合蛋白能够靶向仅在T细胞上存在的CD3受体。在人源化小鼠模型中的体内数据显示了这种载体的特异性,甚至允许体内基因传递以产生功能性CAR T细胞转导。尽管需要更多的工作,但这种方法可以解决体外转导期间潜在的非靶向转导问题。
已经报道了开发不表达CD19抗原的耐药淋巴瘤B细胞,导致CAR T细胞治疗患者复发的情况。为了解决耐药癌症的发展,提出了转基因工程。已经在体外测试了将两到三个CAR构建体引入每个工程细胞,并正在进行临床研究,以防止对CAR疗法产生耐药性的出现,取得了令人鼓舞的结果。
CAR表达水平被证明影响临床结果。仔细选择和设计驱动CAR基因表达的启动子,可以提高CAR表达。CAR转基因的不同组成部分,如跨膜和铰链结构域,也显示出影响CAR表达。优化嵌合受体内细胞和外细胞结构域设计的努力正在进行中。
尽管在治疗血液癌症方面取得了初步成功,CAR T细胞疗法在治疗实体肿瘤方面遇到了障碍,并且成功率有限。实体肿瘤的物理特性以及肿瘤微环境(TME)限制了CAR T细胞有效接触和杀死癌细胞的能力。经常引用的障碍包括细胞穿透肿瘤床的困难、肿瘤内恶劣的生理条件以及癌细胞产生的免疫抑制调节蛋白。这些障碍在血液癌症中不存在,因为它们不形成实体肿瘤癌症类型中看到的大肿瘤床,从而解释了抗CD19 CAR疗法所遇到的成功。最后,为了解决遇到的局限性和安全问题,已经提出了LV和RV载体的替代品。电穿孔就是这样一种替代品,它包括通过细胞传递电流引入pDNA。电流暂时在细胞中生成孔隙,并将带负电荷的mRNA通过细胞悬浮液并进入细胞。由于这种基因转移技术的非整合性质,可以提高安全性,因为随着mRNA的降解和通过细胞分裂的稀释,转基因的表达将逐渐减少。
尽管这些技术提供了安全优势,但长期疗效仍需要在人类试验中得到证明。
4.4.开发基于LV的CAR T细胞疗法研究工具
除了作为将CAR转基因转移到T细胞中的有效和安全工具外,LV载体还被用于开发体内和体外模型。开发体外和体内模型的一个重要部分是开发表达CAR T细胞疗法靶向的肿瘤相关抗原(TAA)的靶细胞。由于患者材料是稀缺资源,并且在伦理上不能在每个研究和开发研究中使用,因此永生化细胞系已成为测试CAR T细胞在临床前研究中性能的流行癌症模型。LV载体已被用于快速修改永生化细胞系,以获得稳定的靶TAA表达,并使用修饰的细胞开发体外杀伤测定,这对于证明疗法的效力和特异性至关重要。然后可以将相同的靶细胞系重新利用并移植,以在体内产生肿瘤模型,以研究疗法的安全性和有效性。小鼠模型在CAR T细胞疗法的体内测试中发挥了重要作用,并用于测试治疗效果和安全性的不同方面。小鼠模型可以分为四类:同系免疫能力,人类异种移植,免疫能力转基因和人源化转基因。所有这些模型都注入了人类或小鼠癌细胞系,以测试CAR T细胞,并且对于理解肿瘤发展和全身对疗法的免疫反应至关重要。提供证据表明在临床前阶段开发的疗法既安全又有效,也是进入人体临床阶段的先决条件。
4.5.开发整合LV的T细胞生物工艺仪器
自体CAR T细胞疗法已被证明是有效的;然而,仍有许多挑战需要解决。生物反应器制造商一直在设计符合GMP生产要求的平台,包括在封闭系统中进行特定适应性改造,以适应T细胞生物加工,例如德国哥廷根Sartorius的ambr 250,美国马萨诸塞州剑桥Aastrom Biosciences的Replicell™系统,瑞士巴塞尔Lonza的Cocoon,以及美国科罗拉多州Lakewood Terumo BCT的Quantum细胞扩增系统。这些系统中最受欢迎的是德国Bergisch Gladbach Miltenyi的CliniMACS Prodigy生物反应器平台。它是一种一次性、完全封闭且符合GMP的T细胞工程解决方案。这个生物反应器有一个培养室,包括一个用于介质交换和配方的离心机,并且可以在较低级别的洁净室环境中操作。该平台包括病毒载体应用线,允许T细胞疗法制造商将LV转导完全整合到生产过程中。它适合自体方法,因为规模仅适应于每个仪器生产单一剂量。尽管这种解决方案不允许规模化生产,但它代表了有希望的规模化解决方案,并且可以用于分散模型,其中剂量更接近或在临床现场生产。这项技术已在I期临床试验现场使用,研究了一种针对非霍奇金B细胞淋巴瘤的双重抗CD19抗CD20 CAR T细胞疗法。14天的生产过程完全整合了使用LV载体转导抗CD19/CD20 CAR基因。在治疗的8名患者中,所有治疗剂量都通过了释放标准,超过了输注所需的细胞数量,并成功给药。这些技术可以提供提高产品质量和生产灵活性的解决方案,并且还可以降低生产成本、物流复杂性和产品变异性。
4.6.使用LV载体的CAR T细胞异体方法
自体CAR T细胞疗法已被证明是当前治疗应用的有效策略。起始细胞材料直接来自患者,减少了与移植物抗宿主病(GvHD)相关的风险。此外,材料的自体性质不会导致产生抗HLA供体特异性抗体(DSAs),这可能限制了整个器官移植和异体T细胞的剂量数量和体内持久性。尽管自体T细胞疗法已被证明更容易开发,但主要限制使这种方法难以扩大规模,以减少生产时间和成本。起始材料的变异性加上低细胞扩增潜力使得在自体T细胞扩增期间难以实现治疗剂量。这是由于从接受多条治疗线的患者中获取的材料的性质,这些患者在接受细胞疗法之前已经符合条件。此外,材料的自体性质意味着每个剂量都特定于每个患者,这排除了任何大规模生产选项,只留下了定制的规模化选项。由于所有这些限制,人们越来越关注一种一刀切模型中的异体方法。在这种情况下,材料将来自通用来源,如基因修饰的供体T细胞、脐带血(UCB)、胎盘、永生化细胞系或诱导多能干细胞(iPSC)衍生的T细胞,为大规模生产打开了可能性。目前,只有基因修饰的供体T细胞和永生化细胞系方法已经进展到临床阶段,因为干细胞衍生的方法仍需要进一步的临床前优化。
2015年,在伦敦大奥蒙德街医院对两名儿童进行了首次异体CAR T细胞疗法的概念验证人体测试。该技术结合了使用抗CD52血清疗法的淋巴细胞清除,然后在CAR T细胞输注之前使用UCART19技术。使用慢病毒载体引入抗CD19 CAR治疗基因,并使用转录激活因子样效应核酸酶(TALEN),这是一种基因编辑工具,用于敲除供体T细胞中的CD52和TCR基因,以避免淋巴细胞清除和避免GvHD。该研究结果显示,在异体CAR T细胞输注后,两名患者在输注后28天实现了分子缓解。UCART19由Cellectis独家授权给Servier,Servier赞助了两项I期临床试验,分别于2016年开始,2020年完成。共有7名儿童和14名成人患有B细胞急性淋巴细胞性白血病。两项试验的发表结果显示,最常见的副作用是CRS(91%)和神经毒性(38%),导致两例治疗相关死亡。总体存活率为55%,无进展生存率为27%。在UCART190初步成功的基础上,Cellectis、Allogene和Servier开始研究使用TCR和CD52 KO CAR T细胞以及抗CD52重组抗体治疗复发或难治性大B细胞淋巴瘤或滤泡性淋巴瘤。异体CAR T细胞(ALLO-501)的给药是在患者自己的免疫细胞使用氟达拉滨、环磷酰胺和重组抗CD52抗体(ALLO-647)进行淋巴细胞清除后进行的。这项技术目前正在22名患者(NCT03939026)的I期、单臂、开放标签试验中进行研究。2020年在美国临床肿瘤学会上提出的初步数据显示,ALLO-501和ALLO-647在19名患者中有12名(63%)产生了客观反应率(ORR),其中37%的有反应患者完全反应(CR)。
尽管异体T细胞供体方法显示出有希望的结果,但仍然需要更多的步骤来敲除或抵消可能引起GvHD的免疫原性T细胞生物学特征。将LV载体技术整合到最先进的异体CAR T细胞疗法生物工艺中,进一步证明了这种方法在T细胞工程中基因转移的相关性。如果正在进行的临床试验获得市场批准,对临床级LV载体的需求和全球供应的压力将进一步增加。这突显了改进工艺和技术以增加T细胞工程LV载体的生产和质量的必要性。
4.7.稳定生产慢病毒载体以满足载体需求增长
为了满足全球需求,已投入努力改进当前的LV生物加工协议,并开发技术以增加生产。大型制药公司一直在投资研究和开发旨在解决瓶颈的技术。一个主要限制是使用HEK293T细胞系生产的LV载体的规模。尽管这种HEK293T粘附细胞与质粒DNA LV系统的瞬时转染可以实现高滴度,但这种细胞系的粘附性质代表了传统规模扩大解决方案(如搅拌罐生物反应器生产)的障碍。近年来,人们尝试解决这种生产方法提出的几个瓶颈。已建议使用专用包装细胞系稳定生产LV载体,作为减少瞬时生产模型中需要大量GMP级质粒DNA的成本的潜在解决方案。在稳定包装细胞系(PCL)中,LV生产所需的病毒基因被稳定地转导到PCL基因组中。可以选择高滴度产生克隆进行载体生产。这种方法已经显示出一些令人鼓舞的结果,尽管与瞬时转染相比滴度仍然较低是一个主要障碍。除了稳定的PCL外,还建议开发HEK 293T细胞的悬浮变体作为替代方案。最近,Chen等人(2020年)在他们的细胞系中结合了悬浮和稳定方面,使用单一稳定转染构建体产生与瞬时转染系统相当的LV滴度。这项技术在搅拌罐生物反应器中进行了测试,提供了扩大生产的潜力;CAR T细胞疗法被引用为潜在应用之一。这项技术最初由意大利米兰的Telethon基因治疗研究所(TIGET)和美国旧金山的Cell Genesys开发,并在罕见疾病战略联盟下转让给GlaxoSmithKline,并获得了专利(专利号PCT/EP2016/078336),概述了未来商业化的潜力。
4.8.针对CAR T细胞疗法应用的专用慢病毒技术
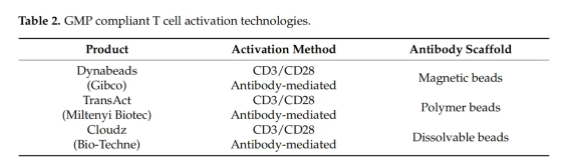
除了提高LV载体的全球生产能力外,为CAR T细胞应用开发专用LV颗粒还可以改善疗法生物加工和生物功能。当使用LV载体进行基因传递时,激活T细胞对于实现高效率的转导至关重要。T细胞的激活还利用了免疫细胞在对抗原反应时自然克隆扩增的能力。T淋巴细胞的这种生物学特性被用来从通过白细胞分离术获得的初始样本中产生足够数量的细胞以治疗患者。这个过程通常使用与抗CD3和抗CD28抗体结合的磁性或聚合物珠子进行,如表2所示。LentiSTIM和RetroSTIM技术(专利号PCT/GB2016/050537)已经开发出来,结合了CAR T细胞的转导和激活。在LV载体从生产细胞出芽时,一些细胞蛋白被携带在病毒包膜上[144]。这种LentiSTIM颗粒是在表达抗CD3和抗CD28膜结合有丝分裂原的细胞系中产生的,随后在LV包膜从生产细胞膜出芽时出现在LV包膜上。同样的方法也被用来在LV包膜上表达生物素基团,以改善下游纯化。这项技术通过减少所需的试剂和工艺步骤以及提高载体纯度,简化了CAR T细胞的生产。
4.9.使用慢病毒技术替代CAR T细胞疗法的方法
TCR T细胞疗法是针对恶性肿瘤的CAR转导T细胞的替代品。这种疗法不是依赖于嵌合抗原受体,而是依赖于修改过的T细胞受体。T细胞被设计为表达具有特定亲和力针对目标抗原的TCR,这种疗法的生产过程与CAR T细胞疗法相同。TCR T细胞的主要优势是,工程化受体使用与未修饰T细胞相同的激活和免疫途径,从而降低了CRS和神经毒性的风险。Adaptimmune Therapeutics, PLC是特定肽增强亲和力受体(SPEAR)技术的拥有者,目前正在赞助或授权几项临床试验,用于治疗实体瘤癌症。SPEAR T细胞包含优化的TCR,并使用编码TCR转基因的慢病毒载体进行生产。首个完成的II期试验是由GlaxoSmithKline赞助的“重定向自体T细胞治疗晚期骨髓瘤”试验(NCT01352286),在第42天有20/25名患者(80%)达到客观反应率(ORR),1年后有11/25名患者(44%)。SPEAR T细胞也在Adaptimmune赞助的II期SPEARAD 1(NCT04044768)和2(NCT04408898)试验中进行临床测试,研究ADP-A2M4疗法治疗滑膜肉瘤、黏液性脂肪肉瘤和头颈癌。重新定向用于通用细胞因子介导杀伤或TRUCKs是另一种替代CAR的受体类型。有时被称为第四代CAR T细胞,TRUCKs已经开发出来,通过细胞因子释放改善CAR T细胞在实体瘤中的效力。当CAR与其目标抗原结合时,基因修饰的T细胞会释放特定的细胞因子,从而抵消肿瘤微环境(TME)的免疫抑制作用。TRUCKs目前正在进行临床研究,并可以提供改善实体瘤中CAR活性的答案。例如,针对转移性结直肠癌的抗EGFR-IL12-CART目前正在进行测试(NCT03542799)。已经开发了特定的慢病毒技术,使用单一慢病毒构建体转导所有生产完全功能的TRUCK所需的元素,进一步提高了这类基于T细胞的免疫疗法的吸引力。
除了嵌合抗原受体的替代品外,还考虑了新的T细胞亚群作为新的潜在治疗细胞。在新的候选细胞中,γδ T细胞、自然杀伤T(NKT)和调节性T(Treg)细胞被建议作为细胞过继治疗和慢病毒技术的有前景的替代细胞类型。γδ T细胞占CD3+ T细胞群体的1-10%。它们是一种高度保守的免疫细胞类型,已经显示出对过继T细胞治疗应用的吸引力。这些包括它们强大的移植物抗肿瘤(GVT)活性以及与异体移植的低GVHD潜力。一项追踪108名癌症患者在接受HSCT后长达3个月的免疫剖面的研究显示,高水平的γδ T细胞与显著更高的总生存率和无复发生存率相关。已经发布和开发了使用慢病毒载体培养和转导γδ T细胞的协议和专利,以包括未来生产的适应性,如无血清培养基培养。一些研究已经进展到I期测试,例如IN8BIO Inc.技术NC200临床试验研究使用慢病毒修饰的γδ T细胞靶向成人胶质母细胞瘤(GBM)。不变自然杀伤T细胞或iNKT细胞也被认为是CAR T细胞治疗的有前景的T细胞亚群。与γδ T细胞一样,它们是T细胞的罕见亚群,占循环PBMCs的不到1%。它们在免疫调节中发挥重要作用,并且已经显示出强大的抗肿瘤活性。iNKT的一个显著优势是能够在不引起GVHD的情况下移植它们,使它们成为“现成”应用的强有力候选者。iNKT细胞已在多项临床试验中使用,包括针对神经母细胞瘤等实体瘤的疗法。使用GRV载体将抗GD2 CAR构建体转导到iNKT细胞中,以靶向神经母细胞瘤。临床前数据对显示体内有效性且无显著毒性,这导致了临床阶段的进展。正在进行的I期临床研究调查CAR iNKTs称为GINAKIT细胞(NCT03294954)与抗体疗法联合治疗复发或难治性高危神经母细胞瘤在1至21岁患者中的有效性。iNKTs也在针对血液癌症的测试中,例如,针对复发、难治、高危B细胞肿瘤的抗CD19 CAR-iNKT疗法目前正在I期试验中(NCT04814004)。
调节性T细胞或Tregs是CD4阳性T细胞的一个亚群,其主要作用是控制免疫反应。与执行促炎功能不同,Tregs对其他免疫细胞类型具有抑制作用,控制对外国病原体的免疫反应并预防自身免疫疾病。Tregs已被建议用于新的有前景的治疗应用,并扩展了过继T细胞治疗的范围,超越了肿瘤学。由于它们自然抑制免疫反应的能力,这些细胞特别适合治疗自身免疫疾病和预防移植物受者的GvHD。首个人体Treg临床试验测试Sangamo CAR Treg产品TX200-KT02已获批准进行I/IIa期(2019-001730-34)。Tregs使用慢病毒载体转导,以表达针对受体的HLA A*2的CAR受体,并预防患有终末期肾病(ESRD)患者的免疫介导的同种异体移植排斥反应。
5.结论
慢病毒载体在基因修饰T细胞治疗的发展中发挥了重要作用。这些逆转录病毒载体代表了一种安全有效的基因转移工具,已经应用于CAR-T细胞疗法近期进展到市场所需的许多开发步骤。慢病毒载体不仅直接应用于CAR治疗基因的转移,还用于开发体外和体内测试所需的靶细胞。慢病毒载体在T细胞治疗发展中的重要性不仅体现在它们整合到T细胞治疗协议中,还体现在用于其制造的仪器设计中。疗法通过后期临床试验的进展和监管机构设立的快速通道计划的准入,以及生物技术和制药行业的积极参与,预示着T细胞治疗在肿瘤治疗武器库中的未来重要性。尽管已经提出了基因转移的替代品,但慢病毒和γ-逆转录病毒载体目前是基因修饰T细胞治疗制造最先进的方法。




